CONTENIDOS: ENLACES A SECCIONES POR TEMA
- NOTAS INTRODUCTORIAS
- POTENCIAL DE MEMBRANA, RELACIONES K/Na Y VIABILIDAD
- CONGELACIÓN VERSUS TEMPERATURA DE FUSIÓN
- AGUA LIBADA Y AGUA A GRANEL
- CLATRATOS HIDRATOS
- TOXICIDADES DE AGENTES CRIOPROTECTORES
- MECANISMOS DE TOXICIDAD DE LOS CRIOPROTECTORES
- MEMBRANAS CELULARES Y LESIÓN POR DESHIDRATACIÓN
- DAÑO POR FRÍO Y CHOQUE POR FRÍO
- ESTÁNDARES PARA LA INVESTIGACIÓN EN CRIONICA
- APÉNDICE: EJEMPLOS DE CÁLCULOS DE qv*
I. OBSERVACIONES INTRODUCTORIAS
La investigación dedicada a la crioconservación de órganos es rara, pero la investigación dedicada por completo a los objetivos de la criónica es aún más rara. Aunque hay mucho que aprender de los criobiólogos, especialmente de los criobiólogos dedicados a la preservación de órganos, los diferentes objetivos de la criónica pueden requerir diferentes métodos.
El objetivo de los especialistas en crioconservación de órganos es maximizar la viabilidad, es decir, maximizar la funcionalidad viva de los órganos recalentados a partir de la crioconservación. Por el contrario, el objetivo de la investigación en criónica es preservar los órganos, especialmente el cerebro, de tal manera que se optimice la restauración mediante la tecnología futura. (Es cierto que esto implica cuestionar las capacidades de la tecnología futura).
Si, por ejemplo, el método de criopreservación A dio como resultado un 60 % de viabilidad y un 80 % de conservación estructural, mientras que el método B dio como resultado un 50 % de viabilidad y un 90 % de conservación estructural, el criopreservador de órganos preferiría el método A, mientras que el crionicista preferiría el método B. Normalmente , una buena estructura conduce a una buena función, pero es posible que (por ejemplo) los métodos para minimizar el daño al recalentarse puedan implicar métodos que no son óptimos para la preservación estructural al enfriarse.
La vitrificación requiere el uso de agentes crioprotectores ("compuestos anticongelantes") para evitar la formación de hielo y/o el daño por congelamiento por aumento de la viscosidad, por enlaces de hidrógeno con moléculas de agua, por dilución de electrolitos y/o por interferencia coligativa. La formación de hielo es un proceso de dos pasos que implica primero la formación de un núcleo (nucleación) y segundo el crecimiento de un cristal de hielo a partir del núcleo.
II. POTENCIAL DE MEMBRANA, RELACIONES K/Na Y VIABILIDAD
Las membranas celulares se pueden llamar membranas semipermeables porque permiten que algunos iones y moléculas pasen más fácilmente que otras, mientras que algunas moléculas no pueden pasar en absoluto. Tanto las concentraciones químicas como las concentraciones iónicas deben alcanzar el equilibrio (equilibrio eléctrico para concentraciones de iones). Algunos iones y moléculas se transportan activamente a expensas de la energía celular. Las células contienen muchas moléculas grandes cargadas negativamente (aniones, A- ) , principalmente proteínas, aminoácidos y fosfatos orgánicos, que son demasiado grandes para atravesar la membrana celular. Las membranas celulares también son normalmente impermeables a los iones de calcio (Ca 2+ ) positivos fuera de la célula.
Los canales de fuga lenta permiten que los iones de potasio (K + ), sodio (Na + ) y cloro (Cl - ) atraviesen la membrana celular. Tanto el K + como el Na + tienen una fuerte atracción eléctrica por los aniones de la célula, pero los canales de fuga lenta permiten que el K + entre en la célula a una velocidad 100 veces superior a la que puede entrar el Na + . Aunque el Na + (número atómico 11) es un ion más pequeño que el K + (número atómico 19), la carga positiva más concentrada hace que el Na + se rodee de moléculas de agua más unidas que el K + . El diámetro hidratado de Na +es de 5 Angstroms, mientras que el diámetro hidratado del K + es de sólo 3,8 Angstroms. Esto permite que el K + hidratado pase a través de los canales de fuga lenta de la membrana mucho más fácilmente que el Na + .
La concentración normal de Na + fuera de una célula es típicamente 10 veces mayor que la que se encuentra dentro de una célula, mientras que la concentración de K + es típicamente 20-35 veces mayor en el interior que en el exterior. En el equilibrio, la fuerte atracción eléctrica que atrae el K + hacia el interior de una célula es igual a la fuerza del gradiente de concentración que tendería a hacer que el K + abandonara la célula.
Los iones Na + y K + que ingresan a una célula son insuficientes para neutralizar la carga negativa de los aniones dentro de la célula. Debido a esto, las células animales tienen una carga negativa neta en su interior. Las membranas animales actúan como condensadores, con una carga negativa en el interior y una carga positiva en el exterior de la membrana. Esta diferencia de voltaje a través de la membrana se llama potencial de membrana . El potencial de membrana en reposo de las fibras nerviosas de los grandes mamíferos es de aproximadamente −90 milivoltios ( mV , negativo dentro de la membrana), mientras que el axón del calamar gigante (que es un excelente modelo para experimentos) tiene un potencial de membrana de −60 mV.
La Ecuación de Nernst proporciona un medio para calcular el potencial de membrana que se produciría para un solo ion que tuviera concentraciones relativamente diferentes a ambos lados de una membrana. Por ejemplo, una relación de entrada/salida de 20/400 para K + da un potencial de Nernst de −75 mV a 25ºC. Para Na + con una relación de entrada/salida de 440/50, habría un potencial de Nernst de +55 mV. Estas cifras ( ECF =ExtraCellular Fluid, ICF =IntraCellular Fluid) corresponden a lo que se encuentra en la membrana de un axón de calamar gigante:
ION | LEC (mM) | CIF (mM) | Potencial de Nernst (mV) |
|---|---|---|---|
| k + | 20 | 400 | -75 |
| na + | 440 | 50 | +55 |
| cl- _ | 560 | 52 | -60 |
| un- _ | -- | 385 | -- |
El potencial de membrana será el resultado de todos los iones, calculado por la Ecuación de Goldman (también conocida como Ecuación de Goldman-Hodgkin-Katz). La Ecuación de Goldman se parece mucho a la Ecuación de Nernst con concentraciones de cationes en el numerador, excepto que las concentraciones se multiplican por las permeabilidades para dar un factor que se ha denominado conductancia . Debido a que K + tiene una permeabilidad relativa tan alta, domina la ecuación de Goldman, lo que hace que el potencial resultante sea casi el mismo que el potencial predicho por la ecuación de Nernst para K + , que es, de hecho, a lo que se aproxima el potencial de membrana en reposo. Sin embargo, cuando un axón se despolariza en un potencial de acción , un Na dependiente de voltajeEl canal + se abre y la permeabilidad al Na + se vuelve temporalmente mucho mayor que la del K + , el término Na + domina la ecuación de Goldman y el potencial de membrana se acerca temporalmente al potencial de Nernst para el Na + .
El potencial de membrana en reposo del axón del calamar gigante es −60 mV, igual al potencial de Nernst del Cl - . De hecho, Cl - se equilibra pasivamente para coincidir con el potencial de membrana que está determinado por los otros iones y fuerzas, razón por la cual Cl - puede ignorarse (eliminarse de la ecuación de Goldman) al calcular el potencial de membrana.
El potencial de membrana se mantiene mediante la denominada bomba de sodio , una enzima de membrana ( Na/K-ATPasa ) que utiliza una molécula de ATP para expulsar 3 iones Na + fuera de una célula mientras introduce 2 iones K + en la célula, un eyección neta de un ion positivo. La bomba de sodio es esencial para mantener el potencial de membrana.
 |
La bomba de sodio no funcionará sin unirse a ATP y Na + dentro de la membrana y K + fuera de la membrana. El veneno uabaína se une a los receptores de K + de la bomba de sodio fuera de la membrana, inactivando así la bomba de sodio. Aunque una célula puede mantener un potencial de membrana durante varias horas sin una bomba de sodio funcional, la fuga lenta de Na + hacia el interior de la célula y la consiguiente fuga de K + hacia fuera de la célula dará como resultado una pérdida completa del potencial de membrana después de varias horas. Del mismo modo, si la célula muere en el sentido de que ya no es capaz de producir energía (ATP) en la mitocondria, la bomba de sodio dejará de funcionar. Por lo tanto, el K + intracelular normalLas proporciones /Na + se pueden utilizar como un índice de viabilidad.
Las proporciones intracelulares de K + /Na + son el método más utilizado para evaluar la viabilidad en la investigación de la criónica, aunque otros métodos (como la medición del contenido de ATP intracelular) podrían ser útiles en el futuro. Para ensayar la relación intracelular K + /Na + , los tejidos se colocan en manitol para lavar los iones extracelulares. Luego se usa ácido tricloroacético para romper las membranas celulares y liberar iones intracelulares. Se puede usar un espectrofotómetro para determinar las concentraciones relativas de iones de sodio y potasio en las células.
tercero CONGELACIÓN VERSUS TEMPERATURA DE FUSIÓN
La mayoría de la gente no sabe que la temperatura a la que se congela el agua pura (agua homogénea ) es mucho más baja que la temperatura a la que se derrite el agua pura. La histéresis térmica existe cuando hay una diferencia entre la temperatura de congelación y fusión, lo que puede resultar en diferentes efectos de calentamiento y enfriamiento en el rango de temperatura entre congelación y fusión, según el historial térmico.
La razón por la que el agua del grifo se congela justo por debajo de los 0 ºC, cerca de la temperatura a la que se derrite ( T m = 0 ºC), se debe a las impurezas que sirven como agentes nucleantes. Las diminutas gotas de agua en las nubes a una altitud de una a ocho millas pueden estar a -15ºC o menos y aun así no se congelarán sin la presencia de un nucleador (p. ej., una partícula de polvo mineral). (El blanco de las nubes se debe al hecho de que, al igual que con la leche, las gotas tienen aproximadamente el tamaño de la longitud de onda de la luz visible. La luz dispersa parece blanca).
Es poco probable que el agua que es perfectamente pura se congele a -5ºC porque un cristal de hielo no puede crecer a esa temperatura sin alcanzar una masa crítica de núcleo cristalino de 45.000 moléculas de agua. Con menos de 45.000 moléculas de agua, el núcleo se disuelve porque el calor de fusión calienta demasiado el núcleo y el efecto de disolución del medio circundante es demasiado grande. El tamaño crítico requerido para el crecimiento de cristales en agua pura a -20ºC es de 650 moléculas de agua, muchas más moléculas de las que se esperaría que se agregaran a esa temperatura en volúmenes y tiempos a escala humana. El agua pura se congela a unos −40ºC ( T h , temperatura de congelación homogénea ) cuando un núcleo solo necesita contener 70 moléculas de agua para ser lo suficientemente grande como para crecer. (Para más información sobre el proceso de nucleación, consulte Algunas propiedades de los metales .)
Los agentes biológicos de nucleación en el medio ambiente son la razón más común por la que el agua se congela justo por debajo de los 0ºC en lugar de a -40ºC. Cuando los núcleos de agua crecen alrededor de un núcleo que no es agua, como el yoduro de plata (AgI) o una proteína bacteriana, el agua se congela por nucleación heterogénea a una temperatura de congelación heterogénea . La bacteria Pseudomonas jeringa que se encuentra comúnmente en las plantas puede elevar la temperatura de congelación del agua a una temperatura de congelación heterogénea de -2ºC. Muchos organismos (como los insectos y los peces del Ártico) tienen proteínas anticongelantes que inhiben la nucleación del hielo, lo que reduce la temperatura de congelación heterogénea.
La temperatura de fusión del agua ( Tm ) , la temperatura de congelación del agua que no contiene agentes nucleantes ( Th ) y la temperatura de congelación heterogénea (temperaturas entre Tm y Th , incluida la primera) se reducen por la adición de agentes crioprotectores. Si se agrega suficiente agente crioprotector, la temperatura de congelación T h se vuelve tan baja que alcanza T g , la temperatura a la cual la mezcla de agua y crioprotector forma un vidrio (se vitrifica) en lugar de congelarse en cristales de hielo [ CRIOBIOLOGY 21(4):407- 426 (1984) ]. T gsuele ser de unos −123ºC para los crioprotectores utilizados en criónica.
(Para obtener más detalles sobre las temperaturas de fusión, nucleación homogénea y heterogénea, consulte BLOQUEADORES DE HIELO ).
IV. AGUA LIBADA Y AGUA A GRANEL
 |
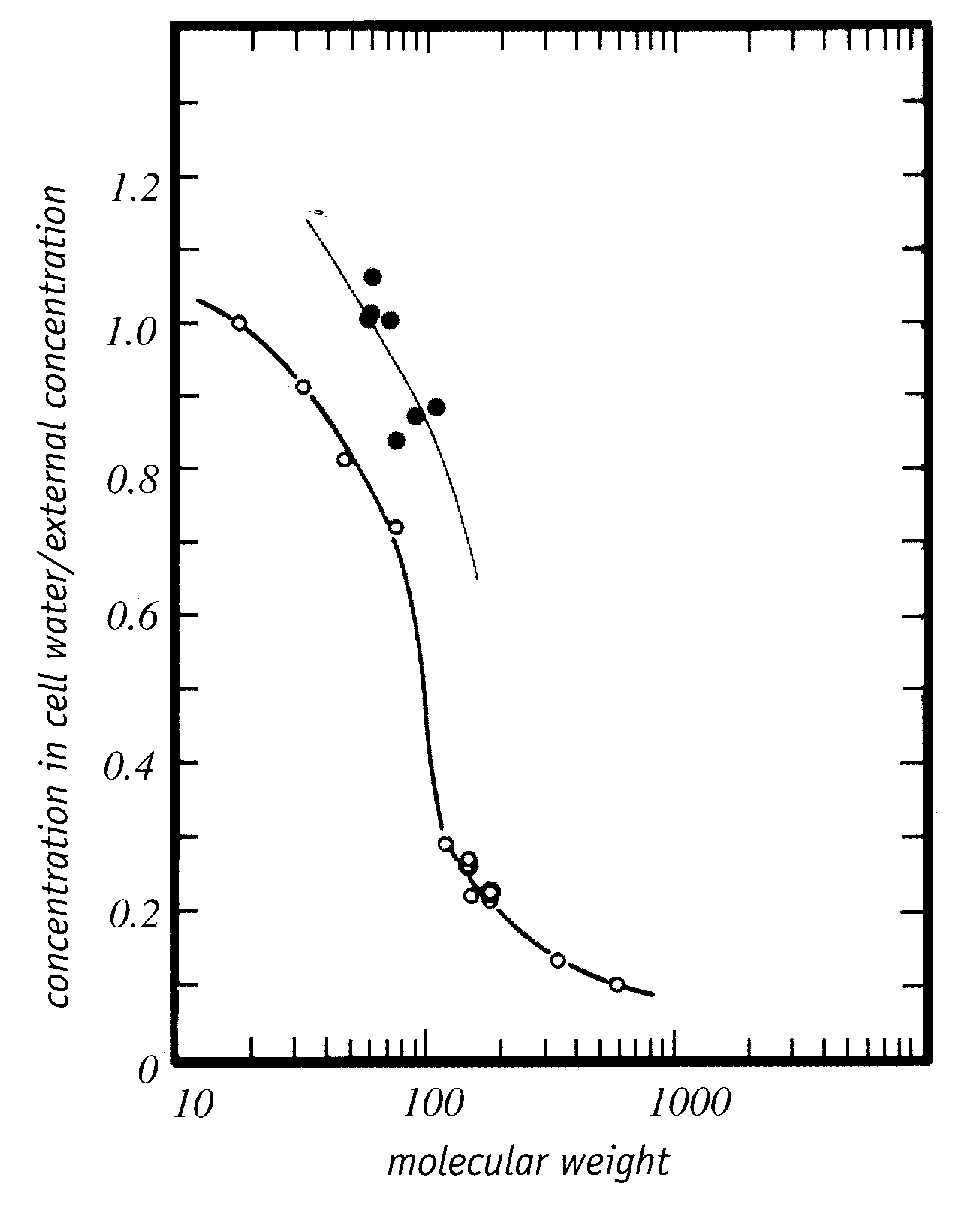
Al menos el 90% del agua en una celda es lo que se puede llamar "agua a granel". El agua a granel es el agua que se puede congelar y/o salir de la célula en respuesta a cambios en la presión osmótica (p. ej., por una solución hipertónica fuera de la célula, que podría deberse a la formación de hielo extracelular). Por el contrario, alrededor del 10% del agua celular es agua ligada que está fuertemente unida por hidrógeno a las superficies hidrofílicas de las macromoléculas (proteínas, ácidos nucleicos o los grupos terminales polares de los fosfolípidos), o moléculas de agua que están fuertemente unidas por hidrógeno a las moléculas de agua unidas directamente a las macromoléculas [ANNALS OF THE NEW ACADEMIA DE CIENCIAS DE YORK; Despa,F; 1066:1-11 (2005)]. El agua unida no abandona osmóticamente la célula debido a la congelación extracelular u otras causas de hipertonicidad extracelular. El agua ligada solo se puede eliminar calentando al vacío. La eliminación del agua a granel no causa daños por deshidratación, pero la eliminación del agua ligada sí causa ese daño, porque las macromoléculas interactúan químicamente cuando no tienen la cubierta protectora que proporciona el agua ligada.
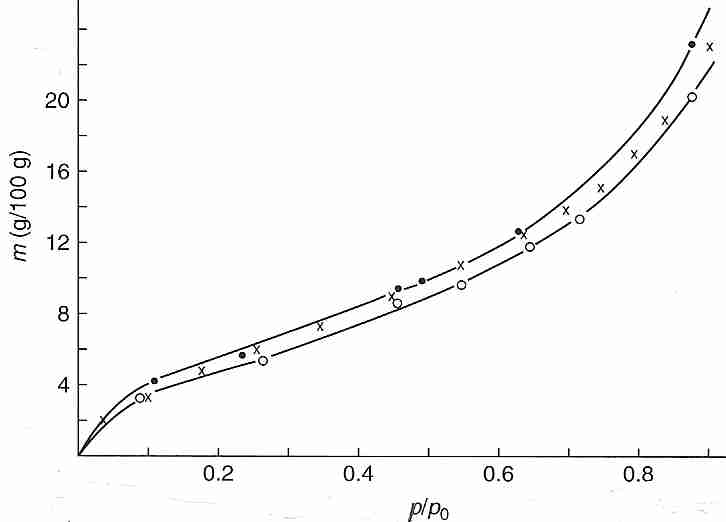
El agua ligada puede demostrarse experimentalmente mediante la presión de vapor ( p ) medida a 25 ºC sobre hemoglobina bovina (nativa, X o desnaturalizada, O ) que ha sido deshidratada mediante varios grados de secado en horno. Graficar el contenido de agua (gramos de agua por 100 gramos de hemoglobina, la variable independiente como el eje vertical) frente a la relación entre la presión de vapor deshidratado y la presión de vapor de agua pura ( p/p o ) demuestra que por encima del 20 % (20 g/ 100 g) de agua, la presión de vapor es casi la misma que la del agua pura ( p/p o > 0,8), lo que significa que la mayor parte del agua es agua a granel que no está unida a proteínas. Con un contenido de agua de alrededor del 10% p/p o se ha reducido a aproximadamente la mitad (0,5) que el agua pura, lo que puede tomarse como una indicación de que el agua restante en el sistema está aún más unida a la proteína. Los experimentos de calorimetría en varias soluciones de proteínas verifican que no hay calor latente de fusión (sin congelación) para el 25 %-30 % del agua, lo que significa que el agua está unida a la proteína. El agua ligada es tan viscosa que se vitrifica a temperaturas criogénicas. Las mediciones del Calorímetro de Barrido Diferencial ( DSC ) de las células sometidas a enfriamiento también indican que al menos el 10 % del agua de la célula es incapaz de congelarse [CRIOBIOLOGÍA; Schrenders,PD; 33(5):487-501 (1996) y CRIOBIOLOGÍA; Sol,WQ; 38(4):372-385 (1999)].
V. CLATRATOS HIDRATOS
![[Hidrato de clatrato que contiene molécula huésped]](https://benbest.com/cryonics/clath1.jpg) | ![[Hidrato de clatrato que contiene molécula huésped]](https://benbest.com/cryonics/clath0.jpg) |
El agua se puede incorporar a los cristales de muchas moléculas inorgánicas y orgánicas dando formas de hidratos . Los cristales de proteína son comúnmente 50% de agua. Pero muchas moléculas no polares y moléculas polares que tienen porciones no polares (como las proteínas) también pueden disolverse en agua sin ningún enlace iónico o de hidrógeno con las moléculas de agua. Los grupos no polares de las proteínas, como el grupo metilo de la alanina, el grupo bencilo de la fenilalanina o el grupo isopropilo de la valina, a menudo son conducidos al interior de las proteínas (plegamiento de proteínas) por la interacción hidrófila con el agua. Aun así, casi la mitad de los grupos no polares de las proteínas pueden encontrarse en el área superficial (área hidratada). A medida que desciende la temperatura, las interacciones hidrofóbicas se debilitan y los enlaces de hidrógeno se fortalecen.
Las moléculas de agua forman un hidrato de clatrato de estructura similar a una jaula alrededor de las "moléculas invitadas" no polares. El hidrato de clatrato se caracteriza por enlaces de hidrógeno entre las moléculas de agua que forman la jaula y las interacciones de van der Waals entre las moléculas de agua y las moléculas huésped en la jaula.
Los gases como el sulfuro de hidrógeno y el metano a menudo se mantienen en soluciones acuosas como clatratos, especialmente a alta presión. Se pueden encontrar más de 6 billones de toneladas de clatrato de metano en las profundidades del fondo del océano. El metano también puede actuar como una "molécula auxiliar" que da como resultado que los alcoholes normalmente solubles en agua (como el alcohol isopropílico ) formen hidratos de clatrato [ EL REVISTA DE FÍSICA QUÍMICA; Alavi,S; 133(7):074505 (2010) ]. El metanol, por el contrario, es un inhibidor de hidratos que se ha utilizado en gasoductos para evitar la formación de hidratos que pueden impedir el flujo. Otros alcoholes pueden ser moléculas huésped o inhibidores de clatrato (dependiendo de la temperatura y la presión) debido a los enlaces de hidrógeno entre la molécula huésped de oxígeno y las moléculas de agua en la jaula.QUÍMICA:UNA REVISTA EUROPEA; Alavi,S; 16(3):1017-1025 (2010) y QUÍMICA FÍSICA FÍSICA QUÍMICA; Makiya,T; 12(33):9927-9932 (2010) ].
![[ Matriz cristalina poliédrica]](https://benbest.com/cryonics/clath2.jpg) |
La estructura en forma de jaula de los clatratos poliédricos alrededor de las moléculas huésped es una estructura de tipo cristalino que se asemeja al hielo y posee un punto de fusión definido. La estructura del hidrato de clatrato de metano en agua líquida es esencialmente la misma que su estructura en hielo, como lo demuestra el hecho de que el calor de solubilización (ΔHº) para la incorporación de metano en agua líquida (−4621 calorías) es prácticamente idéntico al del hielo (− 4553 calorías). Las celdas unitarias de poliedros de clatrato pueden compartir caras para formar una matriz cristalina macroscópica. Las presiones más altas alteran la morfología de los cristales de hidratos, lo que da lugar a cristales de hidratos que se convierten en agua líquida a partir de una película de hidratos [ CRECIMIENTO Y DISEÑO DE CRISTAL; Ohmura,R; 5(3):953-957 (2005)]. El volumen de un clatrato es mayor que el del hielo hexagonal que contiene el mismo número de moléculas, incluso excluyendo la molécula huésped. Por esta razón, se podría esperar que la formación de clatratos en los tejidos biológicos cause más daño mecánico que la congelación. Por otro lado, al evitar la separación de fases de las moléculas de agua en hielo puro, los clatratos (como el xenón) podrían evitar daños debido a la alta concentración de soluto salino.
Un artículo sobre corazones de ratones sometidos a xenón-nitrógeno a 100 psi (6,8 atmósferas) de presión, según se informa, muestra buenas micrografías electrónicas de cardiomiocitos que habían estado en nitrógeno líquido en comparación con controles sometidos a oxígeno-nitrógeno bajo presión [ REVISTA INTERNACIONAL DE PATOLOGÍA CLÍNICA Y EXPERIMENTAL ; Sheleg,S; 1(5):440-447 (2008)]. El documento sugiere que los clatratos formados en la célula reducen la cantidad de hielo extracelular al retener agua en la célula que, de lo contrario, habría migrado a través de las membranas celulares durante el proceso de congelación, protegiendo así a los cardiomiocitos del daño por deshidratación. El documento también sugiere que los clatratos de xenón protegen a las células del daño por recristalización durante el proceso de descongelación. Si la última explicación es cierta, entonces las micrografías mejoradas no son indicativas de una preservación estructural mejorada durante la criostasis. El documento es crítico con la vitrificación debido a la toxicidad de los crioprotectores y otra fuente de lesión a la que se hace referencia vagamente (posiblemente la desvitrificación). Esto se da como una razón por la que no se preparó una muestra vitrificada para la comparación. La vitrificación y la formación de clatratos son enfoques incompatibles para la crioconservación. Los clatratos son estructuras similares al hielo, lo que significa que la vitrificación evitaría la formación de clatratos al menos tan fácilmente como previene la formación de hielo. Aunque los clatratos de xenón pueden ser útiles para la criopreservación a temperatura criogénica de pequeñas muestras de tejido, no pueden aplicarse a la criopreservación de órganos criogénicos o criónica debido al daño mecánico causado por los clatratos de gran volumen.
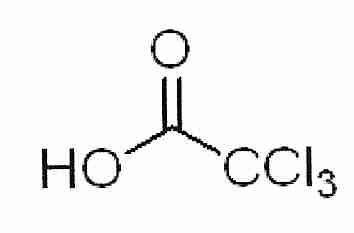
El 2,3-butanodiol es un potente crioprotector que puede vitrificarse en concentraciones más bajas que otros crioprotectores. El 2,3−butanodiol tiene isómeros meso que forman un hidrato que cristaliza fácilmente y es citotóxico [ CRIOBIOLOGY; Sutton,RL; 29(5):585-598 (1992) ]. Queda por ver si la cristalización es responsable de la citotoxicidad, y si los hidratos son hielo nucleante. El levo o dextro 2,3-butanodiol puro (que no incluye los isómeros meso) es muy caro, aunque las soluciones de 2,3-butanodiol con menos del 4 % de isómeros meso no son tan caras.
VI. TOXICIDADES DE AGENTES CRIOPROTECTORES
| CPA de poliol | DMSO |
|---|---|
![[Estructuras de poliol CPA]](https://benbest.com/cryonics/polyols.jpg) | ![[DMSO]](https://benbest.com/cryonics/DMSO.jpg) |
El glicerol puede causar insuficiencia renal al aumentar la generación de peróxido de hidrógeno [AMERICAN JOURNAL OF FISIOLOGY; Guía,B; 257(3 Pt 2):F440-F445 (1989)] y aumento de la liberación de óxido nítrico [INSUFICIENCIA RENAL; Chandler,V; 28(2):161-168 (2006)].
El etilenglicol se metaboliza a glicoaldehído, glioxilato y ácido oxálico [AMERICAN JOURNAL OF KIDNEY DISEASES; Poldelski, V; 38(2):339-348 (2001)]. Los metabolitos tóxicos del etilenglicol pueden causar insuficiencia renal y cardiopulmonar [FORENSIC SCIENCE INTERNATIONAL; Let, PM; 155(2-3):179-184 (2005)]. El glicoaldehído también se ha relacionado con daños en la piel [ARCHIVOS DE TOXICOLOGÍA; Lockley, DJ; 79(3):160-168 (2005). Se ha demostrado que los antioxidantes reducen los efectos tóxicos de las células epiteliales del riñón expuestas al oxalato y al oxalato de calcio [INVESTIGACIÓN UROLÓGICA; Thamilselvan,S; 31(1):3-9 (2003)]. Algunos investigadores afirman que la toxicidad renal se debe únicamente al oxalato de calcio [CARTAS DE TOXICOLOGÍA; Guo,C; 173(1):8-16 (2005)]. Para los ovocitos de ratón, la eliminación de calcio se opone a la toxicidad del etilenglicol [REPRODUCCIÓN Y DESARROLLO MOLECULAR; Takahashi,T;REPRODUCCIÓN; Larman, MG; 131(1):53-61 (2006) ] y propilenglicol [ REPRODUCCIÓN HUMANA; Larman, MG; 22(1):250-259 (2007) ].
Pero la toxicidad de los crioprotectores en criobiología (y criónica) no está relacionada con los efectos sistémicos a largo plazo y de alta temperatura, en particular los productos de descomposición del hígado como los metabolitos de etilenglicol. (El etilenglicol en sí mismo tiene baja toxicidad sistémica). La forma en que se analiza la toxicidad influye en cómo se explica la toxicidad. La relación K/Na es un ensayo de uso común para determinar la viabilidad o la toxicidad (la toxicidad es alta cuando la viabilidad es baja).
Para los cortes de riñón, el glicerol es generalmente el menos tóxico de los agentes crioprotectores ( CPA ) convencionales, que se pueden ordenar por toxicidad como:
formamida > propilenglicol > DMSO > etilenglicol > glicerol
Con la excepción de la formamida, este es el orden exacto de la capacidad vitrificante de estos CPA, siendo el glicerol el CPA menos poderoso y el menos tóxico [CRIOBIOLOGÍA; Baudot,A; 40(2):151-158 (2000)]. La formamida es el CPA más tóxico, pero tiene la menor capacidad de formación de vidrio (no puede vitrificarse por sí misma, pero puede ayudar a la vitrificación con otros crioprotectores). Cuando la formamida y los dos glicoles se combinan con DMSO, la combinación formamida-DMSO es la menos tóxica: el DMSO reduce considerablemente la toxicidad de la formamida (y aparentemente viceversa, consulte la siguiente sección). El orden de toxicidad en este caso es:
DMSO+propilenglicol > DMSO+etilenglicol > DMSO+formamida
Un estudio de blastocistos de ratón [ REVISTA DE REPRODUCCIÓN Y FERTILIDAD; Valdez, CA; 96(2):793-802 (1992) ] usando 30% (v/v) de seis crioprotectores encontró que el glicol de etileno (EG) era con mucho el menos tóxico y el glicol de propileno (PG) casi el más tóxico:
1,3-butanodiol > PG > 2,3-butanodiol > glicerol > DMSO > EG
Sin embargo, para los ovocitos humanos y de ratón, el DMSO puede ser más tóxico que el propilenglicol [REPRODUCCIÓN HUMANA; Gok, DA; 8(7):1101-1109 (1993)]. Y para las células endoteliales humanas, incluso a 2-4ºC, el DMSO y el etilenglicol son mucho más tóxicos que el propilenglicol o el 2,3-butanodiol [CRYOBIOLOGY; WustermanMC; 44(1):24-37 (2002)].
Por el contrario, el DMSO produce mucho menos daño a los ovocitos de búfalo recuperados de la congelación lenta que el etilenglicol o el propilenglicol. Los ovocitos de búfala vitrificados tenían aproximadamente un 40 % más de probabilidades de convertirse en blastocitos con un 40 % de DMSO que con un 40 % de etilenglicol, pero más de 3 veces más probables con un 20 % de DMSO y un 20 % de etilenglicol [ REPRODUCCIÓN, FERTILIDAD Y DESARROLLO; Gautama, SK; 20(4):490-496 (2008) ].
De manera similar, para los embriones de ostras, el DMSO es menos tóxico que el propilenglicol, el etilenglicol o la acetamida. Y la combinación de DMSO con acetamida es menos tóxica que el DMSO o la acetamida solos. La adición del azúcar trehalosa reduce aún más la toxicidad y aumenta la supervivencia [ RECURSOS VIVOS ACUÁTICOS; Chao,N; 7(2):99-104 (1994) ].
Para embriones de lenguado, el orden de toxicidad para concentraciones de CPA al 20 % es:
glicerol = etilenglicol > DMSO > dimetilformamida > propilenglicol > metanol
Ningún embrión de lenguado sobrevive a la exposición a etilenglicol o glicerol [TERIOGENOLOGÍA; Chen,SL; 63(4):1207-1219 (2005)]. Los embriones de lenguado mostraron una reducción significativa en la toxicidad crioprotectora del glicerol, DMSO, propilenglicol y etilenglicol mediante la adición de metanol al 5 % [TERIOGENOLOGÍA; Zhang, YZ; 63(3): 763-773 (2005)].
Para embriones de pez cebra, el orden de toxicidad para una solución crioprotectora al 10% con 48 horas de exposición es:
etilenglicol > metanol > propilenglicol > DMSO
de [TERIOGENOLOGÍA; Lahnsteiner,F; 69(3):384-396 (2008)]
Para los embriones de langostino peneido, el orden de toxicidad de las soluciones crioprotectoras es
glicerol, formamida > propilenglicol > DMSO > etilenglicol > metanol
donde el glicerol fue más tóxico en el estado de mórula, pero la formamida fue más tóxica en el estado de nauplios [CRIOBIOLOGÍA; Newton, SS; 33:172-177 (1996)].
Para la bacteria Escherichia coli , el DiEthylSulfOxide (DESO) es considerablemente menos tóxico que el DMSO o el glicerol [ CRIOBIOLOGÍA; Markarian, SA; 49(1):1-9 (2004) ]:
glicerol > DMSO > DESO
Para el alga Chlamydomonas reinhardtii , la actividad fotosintética (como ensayo de viabilidad ) se redujo a casi un 25 % con DMSO al 7,5 %, pero fue casi normal para el metanol al 7,5 % [ EUROPEAN JOURNAL OF PHYCOLOGY; Crutchfield, ALM; 34(1):43-52 (1999) ].
Se han obtenido resultados variables al comparar el DMSO con la toxicidad del glicerol para diferentes organismos. El DMSO es más tóxico que el glicerol para los espermatozoides de pollo, evaluado sobre la base de la fertilidad [ POULTRY SCIENCE; Tselutina, K; 78(4):586-590 (1999) ]. El protozoario diflagelado Crypthecodinium cohnii muestra un crecimiento mucho mejor después de la exposición al glicerol que al DMSO [ CRYOBIOLOGY; Simone, FP; 14(3):362-366 (1977) ]. (El etilenglicol era extremadamente tóxico para estos protozoos). Por el contrario, la bacteria espiroqueta Leptospira interrogans muestra un efecto mucho más tóxico sobre el crecimiento con glicerol al 2 % que con DMSO al 3 % [ THE JOURNAL OF APPLIED BACTERIOLOGY; Palit,A; 61(5):407-411 (1986) ]. El glicerol es más tóxico que el DMSO para los parásitos de la malaria Plasmodium chabaudi , aunque distinguir los efectos osmóticos de la toxicidad real complica la comparación [ CRIOBIOLOGY; Mutetwa,SM; 21(3):329-339 (1984) ]. La adición de glucosa al medio de recuperación mejoró significativamente la recuperación tras la exposición a ambos crioprotectores. Una solución de glicerol al 50 % es menos tóxica para las puntas de los brotes de menta ( Metha ) que una solución de glicerol al 30 % en combinación con etilenglicol al 15 % y DMSO al 15 % [ CRIOBIOLOGÍA; Volk, GM; 52(2):305-308 (2006) ].
El metanol y la polivinilpirrolidona (PVP) son considerablemente menos tóxicos para las bacterias metanotrópicas que el glicerol o el DMSO [ LETTERS IN APPLIED MICROBIOLOGY; Verde,PN; 14(4):158-162 (1992) ]. La superioridad del metanol y el etanol sobre otros crioprotectores en la crioconservación de la levadura Saccharomyces cerevisiae enfriada rápidamente se atribuye al aumento de la permeabilidad de la membrana más que a la reducción de la toxicidad [ CRIOBIOLOGY; Lewis,JG; 31(2):193-198 (1994) ].
En lugar de evaluar la toxicidad relativa de los crioprotectores en concentraciones absolutas iguales, se puede comparar la toxicidad de los crioprotectores con las células endoteliales en las concentraciones necesarias para vitrificar. Solo el 32 % p/p de 2,3-butanodiol vitrificará las células endoteliales, pero para DMSO, etilenglicol y propilenglicol, se requiere una concentración del 45 % p/p. La comparación de las toxicidades de las células endoteliales a las concentraciones necesarias para vitrificar da como resultado:
DMSO = etilenglicol (45 %) > propilenglicol (45 %) = 2,3−butanodiol (32 %)
lo que hace que el 2,3-butanodiol (generalmente considerado el más tóxico) sea menos tóxico para las células endoteliales que el DMSO o el etilenglicol [ FÍSICA EN MEDICINA Y BIOLOGÍA; Robinson, parlamentario; 47(13):2311-2325 (2002) ]. La reducción de la concentración de 2,3-butanodiol de 3,0 molar a 2,0 molar ha reducido la pérdida de células endoteliales en un factor de 35, mientras que la misma reducción molar de DMSO solo ha reducido la pérdida de células endoteliales en un factor de 3 [ CRYOBIOLOGY; Bourne, WM; 31(1):1-9 (1994) ].
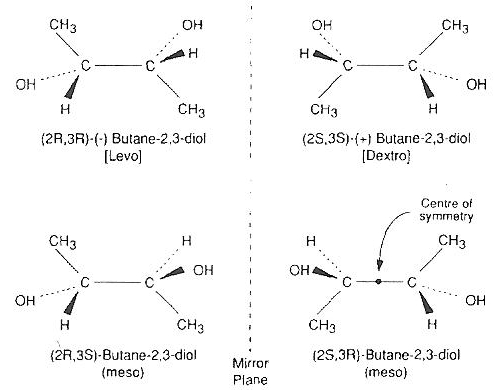 |
El 2,3-butanodiol tiene nominalmente cuatro isómeros, pero dos son isómeros meso idénticos que forman un hidrato que cristaliza fácilmente y es citotóxico [ CRIOBIOLOGÍA; Sutton,RL; 29(5):585-598 (1992) y ORGANOGÉNESIS; Taylor,MJ; 5(3):155-166 (2009) ]. El levo/dextro 2,3-butanodiol puro que no contiene isómeros meso es prohibitivamente costoso para la mayoría de las aplicaciones. La adición de trehalosa o sacarosa al 4 % a una solución de 2,3-butanodiol al 30 % que contiene un 96,7 % de isómeros ópticamente activos (no meso) reduce drásticamente la toxicidad y reduce la velocidad de enfriamiento a la mitad [ CRIOBIOLOGÍA; Bouton,P; 31(4):367-373 (1994) ] aunque agregar un 4% de sacárido es solo la mitad de efectivo para reducir la velocidad de enfriamiento que agregar un 4% más de 2,3-butanodiol [CRIOBIOLOGIA; Baudot,A; 33(3):363-375 (1996) ]. El uso de una solución portadora como Euro-Collins también puede reducir la toxicidad y aumentar la capacidad de formación de vidrio.
Muchos criobiólogos operan como si se aplicaran diferentes reglas de toxicidad a diferentes células, tejidos, órganos y organismos, limitando su enfoque a sus propias especialidades. Una Teoría Unificada de Toxicidad Crioprotectora debe ser posible, y debe ser buscada para tener la comprensión más profunda de los mecanismos. Las plantas, los ovocitos y los embriones de peces están compuestos de proteínas, lípidos, carbohidratos y ácidos nucleicos al igual que los órganos de los mamíferos. Estudiar y comprender una amplia variedad de organismos y tejidos proporciona el mejor potencial para aprender lo que es general y lo que es específico sobre la toxicidad de CPA, que en última instancia debe reducirse a las interacciones de CPA con proteínas, lípidos, carbohidratos, ácidos nucleicos y agua como así como las interacciones de los CPA.
Enumerar los CPA en orden de viscosidad da:
glicerol > propilenglicol > etilenglicol > DMSO
 |
Una buena mezcla de crioprotectores tendrá baja viscosidad, baja toxicidad y buena capacidad vitrificante. La actividad enzimática reducida debido al crioprotector viscoso no debe equipararse con toxicidad [ PROCEDIMIENTOS BIOLÓGICOS EN LÍNEA; Uribe,S; 5(1):108-115 (2003) ].
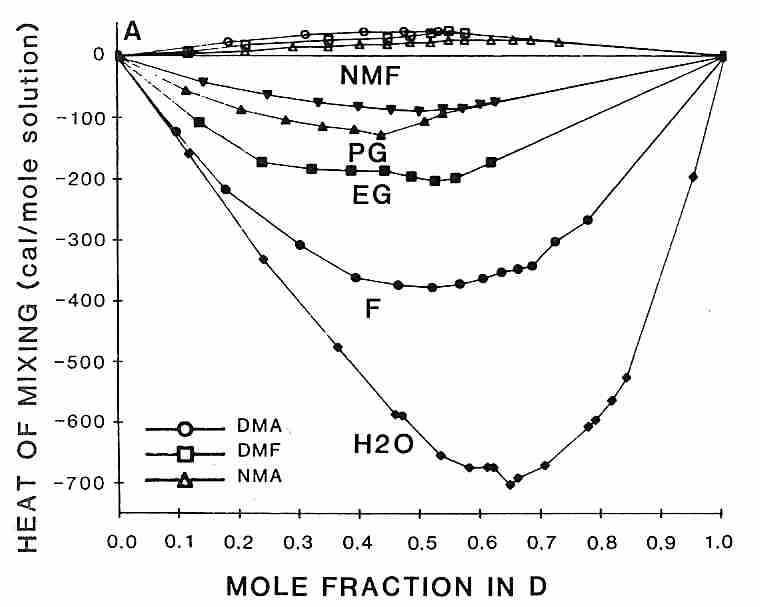
A diferencia de los polioles (glicerol, etilenglicol, propilenglicol, etc.), la toxicidad del DMSO puede reducirse mezclándolo con otros agentes crioprotectores ( CPA ). Curiosamente, el orden de clasificación para la liberación de calor al mezclar DMSO con otros crioprotectores es el mismo que el orden de eficacia para reducir la toxicidad del DMSO [de CRIOBIOLOGÍA; Fahy, GM; 24(3):196-213 (1987)]:
formamida > etilenglicol > propilenglicol > N-metilformamida
probablemente porque asociarse más fuertemente con DMSO corresponde a reducir su toxicidad. La metilación de los polioles aumenta la capacidad de formación de vidrio al mismo tiempo que aumenta la toxicidad debido al aumento de la fuerza de los enlaces de hidrógeno de los grupos hidroxilo [ JOURNAL OF PHYSICAL CHEMISTRY; Forsyth,M; 94:6889-6893 (1990) ].
Los crioprotectores no solo se difunden a través de las membranas celulares a diferentes velocidades, sino que también afectan la velocidad a la que las moléculas de agua se difunden a través de las membranas. El glicerol y el propilenglicol se difunden a través de las membranas espermáticas humanas casi dos tercios más rápido que el DMSO, pero la difusión del agua a través de las membranas espermáticas es casi dos tercios más rápida con el propilenglicol que con el glicerol o el DMSO [ BIOLOGÍA DE LA REPRODUCCIÓN; Gilmore,JA; 53(5):985-995 (1995) ].
 |
La trehalosa es un azúcar crioprotector no tóxico que desplaza el agua unida y protege las membranas celulares mediante enlaces de hidrógeno a las proteínas y los extremos polares de los fosfolípidos con más fuerza que el agua unida [ ARCHIVES OF BIOCHEMISTRY AND BIOPHYSICS 245(1):134-143 (1986)]. Los crioprotectores tóxicos podrían prevenir el daño por deshidratación por los mismos medios, mientras que, sin embargo, causan la desnaturalización de las proteínas, lo que no ocurre con la trehalosa, que tiene enlaces de hidrógeno más débiles. Existe evidencia de que los buenos crioprotectores son aquellos que se excluyen preferentemente de las proteínas, estabilizándolas y oponiéndose a su despliegue o desnaturalización [REVISIONES DE ENTREGA AVANZADA DE MEDICAMENTOS; Arakawa,T; 46(1-3):307-326 (2001)]. Dichos crioprotectores serían lo suficientemente hidrofóbicos para cruzar las membranas celulares con facilidad —los crioprotectores cruzan las membranas celulares mucho más fácilmente de lo que se predice por su peso molecular [Figura 5, QUÍMICA FISIOLÓGICA Y FÍSICA Y RMN MÉDICO 25:177-208 (1993)]— y ser lo suficientemente hidrofílico para mezclarse fácilmente con agua.
VIII. MECANISMOS DE TOXICIDAD DE LOS CRIOPROTECTORES
La comprensión de los mecanismos moleculares de la toxicidad de los agentes crioprotectores sería un paso importante hacia la búsqueda de medios para reducir la toxicidad. Los crioprotectores pueden ser tóxicos de diferentes maneras, pero aparentemente existen características comunes de toxicidad que se correlacionan con la capacidad de crioprotección de las sustancias. En algunos casos, la toxicidad de los crioprotectores se puede confundir con el daño osmótico. Los crioprotectores y sus soluciones portadoras deben proteger contra el daño osmótico, el daño por frío, el daño a las proteínas y el daño a una variedad de orgánulos celulares y tejidos que pueden estar asociados con la administración tanto de enfriamiento como de crioprotectores. Y el tipo de ensayo de viabilidad utilizado puede afectar la evaluación de la toxicidad.
Un estudio de la hemólisis de eritrocitos por alcanoles ( alcanos que tienen un grupo −OH), alcanodioles (alcanos que tienen dos grupos -OH) y glicerol (que tiene tres grupos -OH) mostraron que el grado de hemólisis dependía casi por completo del cambio de forma inducido en los eritrocitos, independientemente del crioprotector utilizado. Cuanto menor era la diferencia entre la hidrofobicidad de la solución y la hidrofobicidad de la membrana, mayor era la extensión de la hemólisis y el cambio de forma. Los alcanoles afectaron principalmente la hidrofobicidad de la membrana, mientras que los alcanodioles afectaron principalmente la hidrofobicidad de la solución. El aumento de la longitud de la cadena dio como resultado un aumento de la hemólisis, mientras que la adición de un grupo hidroxilo para producir un alcanodiol redujo la hemólisis en comparación con el alcanol correspondiente. Las concentraciones de crioprotector que produjeron 100% de hemólisis a 20ºC solo produjeron 5-10% de hemólisis a 4ºC.BIOCHEMICA ET BIOPHYSICA ACTA; Bakalcheva, IB; 1280(1):73-80 (1996) ]. El mismo mecanismo puede estar detrás de la reducción de la toxicidad de la combinación de DMSO y etilenglicol [ REPRODUCCIÓN, FERTILIDAD Y DESARROLLO; Gautama, SK; 20(4):490-496 (2008) ].
Sobre la base del estudio de hemólisis de eritrocitos anterior, parecería que el metanol sería el crioprotector menos tóxico. Un estudio de ovocitos de peces mostró que las concentraciones de metanol por encima de 6 molar (pero no por debajo) dieron como resultado daño proteico o proteolisis [ CRIOBIOLOGY; Lubzens,E; 53(3):398-399 {ABSTRACT 73} (2006) ] Sin embargo, el metanol es muy hidrofóbico y es un crioprotector débil.
Se han encontrado correlaciones entre la toxicidad de los crioprotectores y la desestabilización de proteínas en las membranas celulares [PHARMAZIE; Ivanov, TI; 56(10):808-809 (2001)]. El DMSO perturba las membranas celulares, posiblemente por desplazamiento del agua [BIOCHEMICA ET BIOPHYSICA ACTA; Oeste,P; 1664(2):217-223 (2004)]. El DMSO es más hidrofóbico a temperaturas más altas, por lo que hay menos deshidratación (toxicidad) de la membrana de DMSO a temperaturas más bajas [ BIOPHYSICAL JOURNAL; Suma,AK; 85(6):3636-3645 (2003)]. La ruptura de la membrana por DMSO aumentó ligeramente (en lugar de reducirse) mediante la adición de formamida para temperaturas superiores a 5ºC [BIOCHEMICA ET BIOPHYSICA ACTA; Anchordogny,TJ; 1104(1):117-122 (1992)]. El DMSO oxida los grupos sulfhidrilo, un efecto que se espera que disminuya con temperaturas más bajas [COMUNICACIONES DE INVESTIGACIÓN BIOQUÍMICA Y BIOFÍSICA; Nieve,JT; 64(1):441-447 (1975)]. El DMSO, el glicerol y especialmente el propilenglicol pueden formar formaldehído potencialmente tóxico mediante reacciones no enzimáticas [ REPRODUCCIÓN HUMANA; Karran,G; 11(12):2681-2686 (1996) ]. Se ha demostrado que el DMSO, la formamida y el metanol disuelven el ADN a altas concentraciones y temperaturas superiores a 20ºC [ BIOTECNOLOGÍA Y BIOINGENIERÍA; Bonner,G; 68(3):339-344 (2000) ].
El análisis espectroscópico de la enzima lisozima disuelta en soluciones concentradas (cerca de los límites de solubilidad) de crioprotectores mostró una pérdida completa de estructura para DMF, DMSO y formamida, mientras que se conservó algo de estructura para los otros crioprotectores en el orden glicerol > etilenglicol > metanol [ BIOTECNOLOGÍA Y BIOINGENIERÍA; Knubovets,T; 63(2):242-248 (1999) ]. La enzima termolisina se inactiva en un 95 % con una dimetilformamida (DMF) al 50 % a 80 °C en 20 minutos, pero una solución de DMSO al 50 % solo produce una inactivación del 10 % en las mismas condiciones. La adición de 20 % de glicerol reduce la inactivación por DMF al 90 % y la trehalosa reduce la inactivación en un 80 % [ JOURNAL OF BIOTECHNOLOGY; Pazhang,M; 127(1):45-53 (2006)]. Para las puntas de los brotes de menta, la sacarosa reduce la toxicidad del etilenglicol y DMSO a 22ºC y del glicerol a 0ºC [ CRIOBIOLOGÍA; Volk, GM; 52(2):305-308 (2006) ]. Se ha demostrado que la adición de trehalosa al 5 % a una solución de DMSO al 10 % mejora la supervivencia de las células nucleadas de la sangre del cordón entre un 7 % y un 25 %, según el tipo de célula [ TRANSFUSIÓN; Zhang,XB; 43(2):265-272 (2003) ].
La toxicidad de los crioprotectores podría ser causada por la desnaturalización de las proteínas (la hipótesis de la desnaturalización de las proteínas ) [CRIOBIOLOGÍA; Arakawa,T; 27:401-415 (1990)], aunque existe evidencia de que las proteínas en general no se desnaturalizan a las temperaturas y concentraciones crioprotectoras relevantes para la vitrificación [CRIOBIOLOGÍA; Fahy,G; 27:247-268 (1990)].
Descubrimientos recientes brindan pistas sobre por qué las sustancias que brindan la crioprotección más poderosa en bajas concentraciones son las más tóxicas. Para los cortes de riñón, los crioprotectores que vitrifican más poderosamente son aquellos que se unen con más fuerza al agua, lo que interfiere con los enlaces de hidrógeno agua-agua que son la base del hielo [ CRIOBIOLOGÍA 48(1):22-35 (2004) ) & CRIOBIOLOGÍA 48(2):157-178 (2004)]. Pero esos mismos crioprotectores también pueden formar puentes de hidrógeno más fuertes con las proteínas, lo que provoca el mayor despliegue y la mayor desnaturalización de las proteínas (enzimas). Los crioprotectores menos tóxicos evitan la formación de hielo mediante enlaces de hidrógeno débiles, pero lo que es más importante, mediante la interferencia coligativa con la formación de hielo. Por esta razón, se logró un gran avance para la crioconservación de órganos al sustituir el propilenglicol por etilenglicol en la solución VS55 (también conocida como VS41A) (que es DMSO 3,1 molar, formamida 3,1 molar y propilenglicol 2,2 molar en solución EuroCollins).
Aunque la mayor toxicidad de los crioprotectores que forman puentes de hidrógeno con mayor fuerza se explica por la hipótesis de la desnaturalización de las proteínas , también se puede explicar por la hipótesis del daño por deshidratación .afirma que los crioprotectores tóxicos causan daños por deshidratación al unirse a las moléculas de agua, lo que impide que las moléculas de agua hidraten adecuadamente las proteínas y otras macromoléculas. Hay mucha evidencia en contra de esta explicación. El daño por deshidratación solo es causado por la eliminación del agua ligada. El agua ligada es de 20 a 100 veces más viscosa que el agua a granel. El agua ligada puede permitir que las células deshidratadas con alto contenido de proteína se vitrifiquen sin crioprotector. Los poderosos crioprotectores tóxicos en dosis bajas encontrarían mucha agua a granel para formar puentes de hidrógeno. Cualquier molécula de agua unida a un enlace de hidrógeno por una molécula crioprotectora sería reemplazada instantáneamente por una molécula de agua a granel.
Hasta hace poco, no había forma de predecir la toxicidad de los crioprotectores. Producir cócteles crioprotectores con baja toxicidad y alta capacidad de vitrificación fue una cuestión de ensayo y error al azar. Sin embargo, con la patente 6.395.467 (inventores Dr. Gregory M. Fahy y Dr. Brian Wowk) se puede usar una métrica simbolizada como qv* para cuantificar la toxicidad en función de los grupos polares moleculares en la concentración necesaria para vitrificar. Para
M W moles de agua
q = ------ = ------------------------------------ -----------------------------
M PG moles de grupos polares en crioprotector penetrante
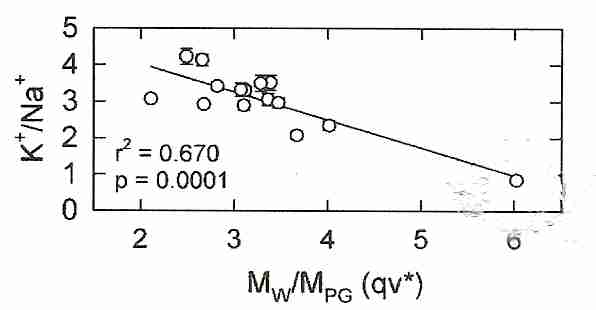 |
la cantidad qv* puede usarse para controlar la toxicidad crioprotectora — donde qv* se refiere a q en una concentración necesaria para vitrificar ( C v , la " v " en qv* ) 5-10 ml de solución a una velocidad de enfriamiento de aproximadamente 10ºC por minuto (el " * " en qv* ) hasta la temperatura de transición vítrea ( T g ). Los moles de grupos polares ( MPG ) se obtienen por simple conteo. Por ejemplo, M PG de glicerol tiene 3 grupos hidroxilo, M PG de etilenglicol tiene 2 grupos hidroxilo y M PGde DMSO es 1 (el grupo sulfinilo del sulfóxido). La toxicidad y la capacidad de formación de vidrio varían linealmente con qv* . Para la mayoría de los crioprotectores, qv* está en un rango entre 2 y 4, pero el DMSO tiene un qv* de alrededor de 6. (Tenga en cuenta que v y * definen las condiciones estándar de q ; no se multiplican por q ). Minimizar los resultados de qv* en vitrificación con mínima toxicidad.
El propilenglicol y la formamida tienen dos grupos polares. Los crioprotectores con menos grupos polares tendrán una q alta y probablemente una qv* alta . Una solución con un alto qv* vitrificará con menos grupos polares por molécula de agua, lo que probablemente significa que hay un enlace de hidrógeno más fuerte con el agua. Los enlaces de hidrógeno más fuertes significan una mayor toxicidad. Para mezclas de crioprotectores, qv* mide la fuerza de enlace de hidrógeno promedio para la mezcla. Se sugiere que la toxicidad de un alto qv* se debe a una reducción en el agua disponible para la hidratación de proteínas, membranas y otras biomoléculas celulares.
Intuitivamente, uno podría imaginar que debido a que los agentes vitrificantes más fuertes pueden lograr una alta vitrificación a la concentración más baja, los agentes vitrificantes más fuertes serían los agentes menos tóxicos (menos agua desplazada y menos crioprotector total en los tejidos). Pero el concepto qv* reveló que los crioprotectores penetrantes (es decir, los crioprotectores que pueden atravesar las membranas celulares, como el propilenglicol y el etilenglicol) que requieren las concentraciones más altas para vitrificar y desplazar la mayor cantidad de agua, son en realidad los menos tóxicos. Por lo tanto, el etilenglicol requiere una concentración más alta para vitrificar que el propilenglicol, pero es menos tóxico en el Cv , a pesar de que el Cv del etilenglicol es menor queCv para propilenglicol . Los inventores de la patente especularon que la explicación de este efecto es que, aunque las concentraciones más altas de crioprotector con enlace de hidrógeno débil dan como resultado concentraciones más bajas de agua, las concentraciones más bajas de agua pueden romper más fácilmente los enlaces con el crioprotector para hidratar las moléculas críticas para la vida. . Las amidas son útiles porque reducen qv* , aunque tienen una toxicidad que es independiente de qv* , una toxicidad que no es aditiva a la toxicidad del DMSO [CRIOBIOLOGÍA; 27;247-268 (1990) & CRIOBIOLOGY 48(1):22-35 (2004)].
(Para ver ejemplos de cálculos de qv*, consulte el apéndice ).
Los investigadores de 21st Century Medicine (21CM) han obtenido sus mejores resultados al usar combinaciones de crioprotectores para una buena vitrificación con la menor toxicidad. La mayoría de los CPA, en particular las amidas, pueden reducir la toxicidad del DMSO cuando se usan en combinación con DMSO. La solución de vitrificación más efectiva y menos tóxica del investigador de 21CM Dr. GM Fahy durante casi una década fue VS4 (Solución de vitrificación 4), compuesta por 14 % p/v de DMSO, 14 % p/v de formamida, 11 % p/v de propilenglicol y 10 % p/v de coloide [TRANSPLANTATION 70(1):51-57 (2000)], aunque esta mezcla solo puede vitrificar a 1000 atmósferas de presión. El aumento de propilenglicol a alrededor del 17 % p/v permitió la vitrificación a una presión de 1 atmósfera, por lo que la fórmula modificada se denominó VS41A. Cuando se reemplazó el propilenglicol con un compuesto metoxilado, la viabilidad resultante fue ligeramente superior a la observada con la solución de vitrificación original (aunque este resultado no fue estadísticamente significativo y no se repitió). Sin embargo, al reemplazar el propilenglicol con etilenglicol, los investigadores de 21 CM aumentaron significativamente la viabilidad, y el nuevo cóctel se llama Veg , es decir , V S41A con etilenglicol .
 |
Durante casi dos décadas se asumió que la formamida reduce la toxicidad del DMSO, pero este punto de vista fue revisado en 1990 con evidencia de que es el DMSO el que reduce la toxicidad de la formamida [CRIOBIOLOGÍA; Fahy, GM; 27:247-268 (1990)]. Concentraciones crecientes de formamida añadidas a cortes de corteza renal a 0ºC dan como resultado una curva de viabilidad decreciente. Pero agregar DMSO al 15 % y al 20 % de formamida aumenta la viabilidad de los cortes renales a casi el 100 %. A 0ºC, el DMSO no es tóxico hasta concentraciones del 30 % para muchas células y tejidos, por lo que podría ser incorrecto pensar que el DMSO no solo reduce la toxicidad de la formamida, sino que la formamida reduce la toxicidad del DMSO.
En general, las combinaciones de crioprotectores son menos tóxicas que las soluciones crioprotectoras de agente único. Para los condrocitos articulares humanos, la formamida es el agente individual más tóxico, pero el propilenglicol mostró la menor reducción de la toxicidad cuando se usó en combinación con otras sustancias crioprotectoras de cualquiera de los crioprotectores probados [ CRIOBIOLOGÍA; Almansoori, KA; 64(3):185-191 (2012) ].
La concentración de crioprotectores penetrantes (y, por tanto, la toxicidad) también se puede reducir mediante la adición de crioprotectores no penetrantes, como polímeros de gran peso molecular (p. ej., polivinilpirrolidona o polietilenglicol) o sacarosa. Los crioprotectores no penetrantes son demasiado grandes para difundirse en las células, pero ayudan con la vitrificación del agua (y la inhibición de la desvitrificación) en el espacio extracelular. Se necesita menos crioprotector dentro de las células que en el espacio extracelular debido a la deshidratación (que conduce el agua de las células al espacio extracelular) y porque las células contienen naturalmente proteínas que mejoran la vitrificación. La patente 6.395.467 informa sobre la optimización de la vitrificación con crioprotectores y la minimización de la toxicidad mediante un uso juicioso de (1) crioprotectores penetrantes (selección basada enqv* ) (2) crioprotectores no penetrantes y (3) bloqueadores de hielo.
Al agregar bloqueadores de hielo y una mezcla juiciosa de otros CPA a Veg , los investigadores de 21CM desarrollaron una nueva solución de vitrificación llamada M22 (llamada así debido a la intención de introducir este cóctel de vitrificación en una muestra biológica a menos de 22 ºC). M22 se ha utilizado para vitrificar un riñón de conejo a -135ºC, que posteriormente se recalentó, se trasplantó a un conejo y mantuvo la vida del conejo como el único riñón funcional [ ORGANOGÉNESIS; Fahy, GM; 5(3):167-175 (2009)]. El etilenglicol es un formador de vidrio más fuerte que el 1,3-propanodiol [CRIOBIOLOGÍA; MacFarlane,DR; 27:345-358 (1990)], y según el modelo qv* se esperaría que fuera menos tóxico (aunque no fue uno de los CPA probados en los estudios qv* publicados) [CRYOBIOLOGY 48(1):22-35 (2004)]. Sustituir el etilenglicol por 1,3-propanodiol (o una mezcla de los dos) podría traer más beneficios en la línea de reemplazar el propilenglicol con etilenglicol, aunque el 1,3-propanodiol es una molécula más grande que puede no penetrar en los tejidos tan fácilmente como etilenglicol.
En general, las toxicidades de los crioprotectores son menores a temperaturas más bajas y pueden incluso volverse insignificantes si los crioprotectores se pueden introducir a una temperatura lo suficientemente baja. Al perfundir el cerebro en el Cryonics Institute, primero se introduce etilenglicol, lo que puede permitir alcanzar temperaturas bajo cero (sin congelación) antes de introducir una mezcla de DMSO/etilenglicol. El etilenglicol también reduce la toxicidad del DMSO.
Un estudio encontró una gran reducción de la fertilidad de los ovocitos humanos del DMSO a 37 ºC (temperatura del cuerpo humano) durante 30 minutos, pero ninguna reducción de la fertilidad a 4 ºC [REPRODUCCIÓN HUMANA; Pickering,SJ; 6(1):142-143 (1991)]. Un estudio similar de fibroblastos dérmicos neonatales humanos encontró que el DMSO al 17 % (v/v) causó una pérdida de viabilidad del 50 % después de 20 minutos a 37 °C, pero a 4 °C se requirió el 37 % (v/v) de DMSO para causar la misma pérdida de viabilidad. en 20 minutos [CRIOBIOLOGIA; Wang,X; 55(1):60-65 (2007)]. Desafortunadamente, los crioprotectores se vuelven cada vez más viscosos a baja temperatura, lo que reduce su capacidad de difusión en los tejidos. Por lo tanto, existe una compensación de toxicidad reducida y el requisito de mayores tiempos de exposición para lograr la saturación del tejido a baja temperatura.
¿Qué importancia tiene la toxicidad de los crioprotectores para la criónica? ¿Puede la tecnología del futuro reemplazar fácilmente las proteínas desnaturalizadas? Las enzimas deben ser fáciles de reemplazar y las proteínas de membrana desnaturalizadas pueden no causar tanto daño estructural como para evitar una reconstrucción fiel. No obstante, el objetivo de la investigación criobiológica dirigida por la criónica debe ser causar la menor cantidad de daño posible, disminuyendo así la dependencia de la tecnología futura. Reducir el daño disminuye la posibilidad de daño irreparable (es decir, destrucción).
(Para obtener más información sobre las propiedades crioprotectoras, consulte VITRIFICACIÓN CON CRIOPROTECTORES SIN GLICEROL ).
VIII. MEMBRANAS CELULARES Y LESIÓN POR DESHIDRATACIÓN
| Lecitina | Membrana |
|---|---|
![[Lecitina]](https://benbest.com/cryonics/lecithin.jpg) | ![[Membrana]](https://benbest.com/cryonics/Bilayer.jpg) |
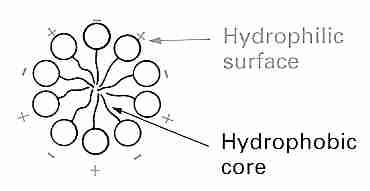
Las membranas de las células y los orgánulos (p. ej., mitocondrias, núcleos, lisosomas, etc.) son principalmente bicapas de fosfolípidos que contienen proteínas y colesterol. La membrana que rodea a una célula (plasmalema) contiene, además, proteínas con carbohidratos adheridos (glucoproteínas) en la superficie exterior. Un fosfolípido tiene una cabeza hidrófila ("amante del agua", no lipídica, cargada, polar) (compuesta por un fosfato y una base), así como una cola hidrófoba ("temerosa del agua", lipídica, no cargada, no polar)de ácidos grasos. Una "columna vertebral" de glicerol conecta la cabeza y la cola. El fosfolípido lecitina (fosfatidilcolina), por ejemplo, conecta el glicerol (y los ácidos grasos unidos al glicerol) a una molécula de fosfato (y la base de colina unida al fosfato). Dicho de otra manera, en un fosfolípido, una molécula de glicerol unida a un grupo fosfato sirve como medio para conectar una base hidrofílica a dos ácidos grasos hidrofóbicos. En una bicapa de fosfolípidos, los grupos de cabeza hidrófilos están orientados hacia las superficies exterior e interior, donde pueden formar enlaces de hidrógeno con el agua, mientras que las colas hidrófobas están orientadas hacia el interior de la membrana, donde son atraídas por otras colas hidrófobas por la fuerza de van der Waals. .
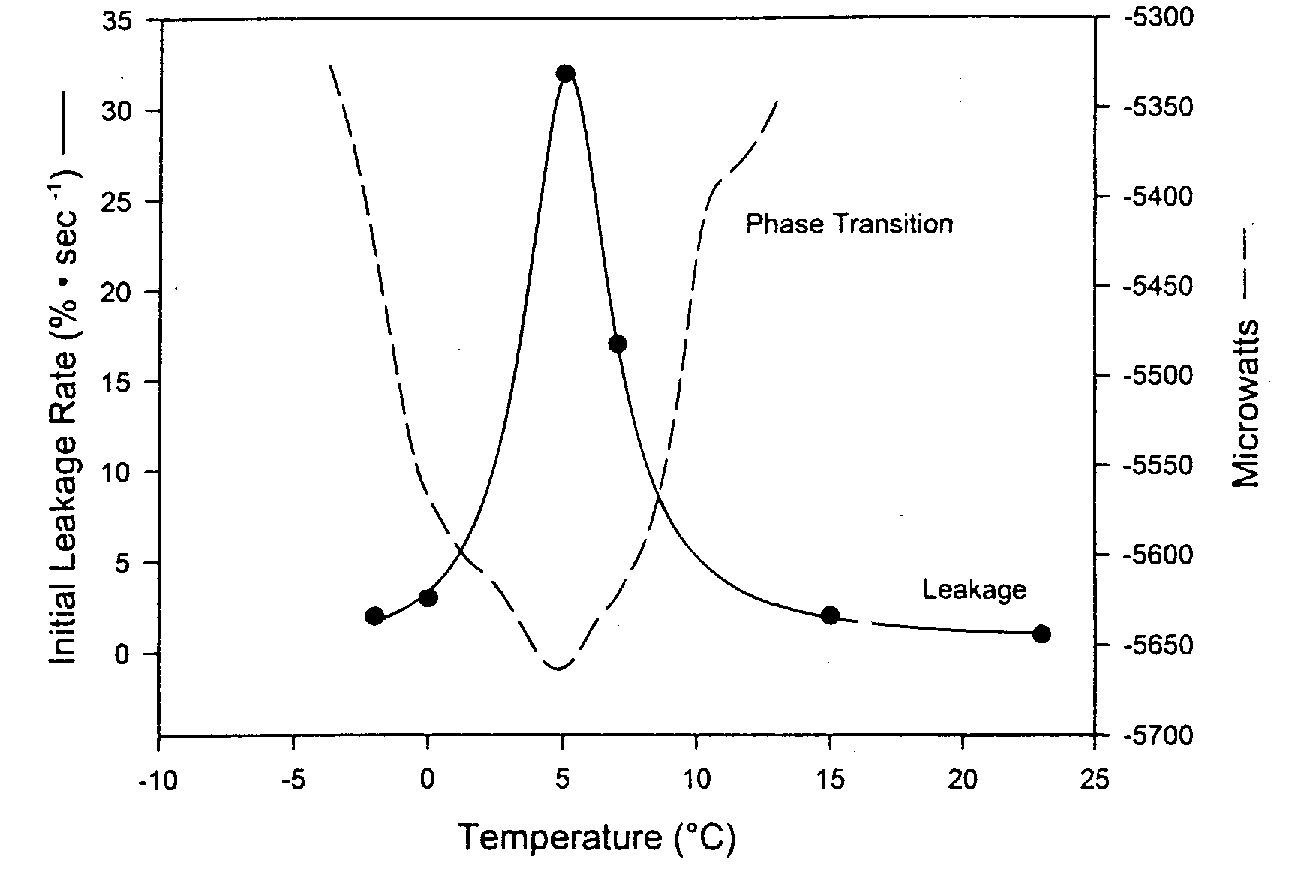 |
Las membranas de bicapa de fosfolípidos se han denominado cristales líquidos porque la organización perpendicular de los fosfolípidos tiene un aspecto cristalino . Pero la bicapa se describe como un líquido porque las cadenas lipídicas están sueltas y los fosfolípidos permiten que las proteínas de la membrana se muevan lateralmente o giren alrededor de un eje perpendicular al plano de la membrana. Sin embargo, en contraste con esta fase líquida , las bicapas de fosfolípidos pueden adoptar una fase de gel más sólida en la que las cadenas lipídicas de la cola se vuelven más rígidas, ordenadas y empaquetadas. Esta transición de fase (llamada transición de fase termotrópica) es muy parecido a la solidificación de la grasa en una sartén. De forma análoga a la transición de fase en la que el hielo sólido se derrite para formar agua líquida, la temperatura de transición de fase termotrópica se denomina temperatura de fusión , T m (un rango de temperaturas, entre 0ºC y 10ºC en el ejemplo del diagrama).
Al bajar o elevar la temperatura, se observa el máximo daño y fuga de las membranas a la temperatura de transición de fase debido a los defectos de empaquetamiento en los límites de fase entre las porciones de líquido y gel de la membrana. Se observan muchas menos fugas por debajo (y por encima) de la temperatura de transición de fase termotrópica. Los tensioactivos (detergentes) pueden empeorar este daño. Un enfriamiento y calentamiento más rápido a través de T m reduce el daño y la fuga de la membrana [CRIOBIOLOGÍA; Hayes,LM; 42(2):88-102 (2001)]. Se observan temperaturas de transición de fase ( Tm ) más altas para membranas que contienen porcentajes más altos de grasa saturada. Algunos organismos en realidad pueden aumentar la insaturación de los lípidos en sus membranas en respuesta a la disminución de la temperatura, lo que reduce la Tm y protegiendo contra el daño de la membrana que ocurre en Tm .
La deshidratación y las lesiones por deshidratación son relevantes para todas las formas de crioprotección. En la vitrificación , en la que el agua se reemplaza por crioprotector, habrá al menos una deshidratación temporal asociada con el "ciclo de contracción-hinchazón" debido al hecho de que el agua sale de las células más rápido de lo que pueden entrar los crioprotectores. Un grupo de cabeza polar de fosfatidilcolina normalmente forma enlaces de hidrógeno con unas diez moléculas de agua. La hidratación de los grupos de cabeza afecta significativamente a la Tm . Si se elimina el agua, T m aumenta considerablemente porque los grupos de cabeza se juntan más estrechamente.
 |
Los liposomas son esferas de fosfolípidos que se utilizan como modelos experimentales para comprender las propiedades de la membrana. La Tm para liposomas hidratados de fosfatidilcolina es de aproximadamente -10ºC, pero la deshidratación de los liposomas aumenta la Tm hasta aproximadamente 60ºC . La adición de azúcares como la trehalosa reduce considerablemente la T m para los liposomas deshidratados (y las bicapas de fosfolípidos) mediante enlaces de hidrógeno entre los grupos de cabeza y, por lo tanto, permite un movimiento más libre de las colas hidrofóbicas [ BIOPHYSICAL JOURNAL; Koster,KL; 78(4):1932-1946 (2000) ]. Reducir la T m con azúcar puede significar que la deshidratación no elevará la T m , lo que causaríaT m para pasar a través de la temperatura ambiente, lo que resulta en daño a la membrana. La trehalosa puede reducir la T m lo suficiente como para evitar daños en la membrana durante la liofilización (secado por congelación).
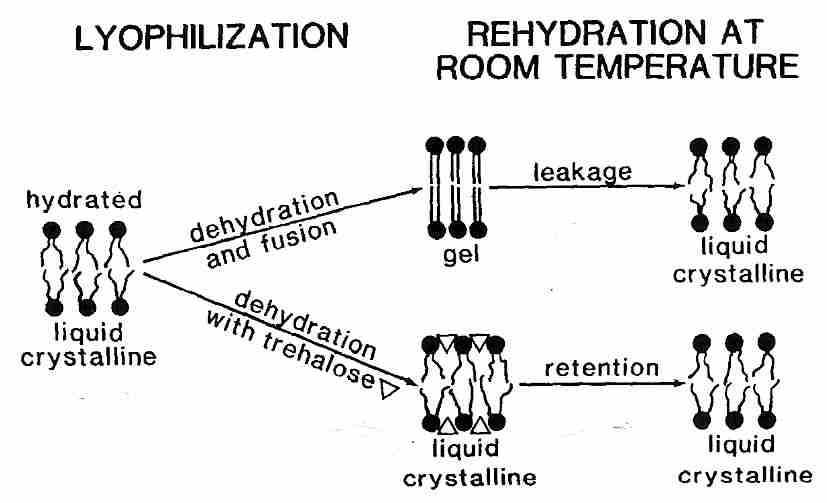 |
Sin embargo , la reducción de la Tm no es suficiente para prevenir el daño por deshidratación de los liposomas y las bicapas de fosfolípidos. Con o sin azúcares, la deshidratación de los liposomas hace que se agrupen y se fusionen. Fusión significa que muchos lisosomas pequeños se unen para formar unos pocos lisosomas grandes. La fusión de las membranas celulares daña claramente los tejidos y provoca una fuga considerable del contenido celular. Sin embargo, la fusión se puede prevenir mediante vitrificación .
La sacarosa pura se derrite y se descompone en caramelo por encima de los 186 ºC, pero como líquido azucarado se puede sobreenfriar para solidificarse en un estado vítreo (no cristalino) a 65 ºC. Esta temperatura de transición de fase se llama Tg , la temperatura de transición vítrea . Las mezclas de agua y sacarosa también pueden ser líquidos almibarados por encima de Tg y sólidos vítreos por debajo de Tg . Con cantidades crecientes de agua, la Tm de la mezcla de sacarosa y agua cae muy por debajo de 0ºC con tan solo un 10% de agua [ BIOPHYSICAL JOURNAL; Sol,WQ; 70(4):1769-1776 (1996) ]. La deshidratación de los liposomas en un medio de azúcar eleva la Tg . Desvitrificacióndebido a un aumento de T g que pasa a través de la temperatura ambiente en asociación con la deshidratación es incluso más dañino que un aumento de T m por encima de la temperatura ambiente. La mejor estrategia es mantener la Tm muy por debajo de la temperatura ambiente y la Tg muy por encima de la temperatura ambiente. La trehalosa pura tiene una T g de 120 ºC, muy superior a la de la sacarosa (75 ºC) [REVISTA DE QUÍMICA FÍSICA B; Lerbret,A; 109(21):11046-11057 (2005)] o glucosa (30ºC). Por lo tanto, aunque la trehalosa no es mejor que la sacarosa en su capacidad para reducir la Tm de deshidratación , la Tg alta de trehalosa (junto con su resistencia a la hidrólisis) lo convierte en el azúcar preferido para su uso en la conservación por deshidratación.
Los azúcares vitrificados interactúan con los lípidos de la membrana de manera diferente que los azúcares no vitrificados. Las interacciones específicas (p. ej., enlaces de hidrógeno) entre los azúcares y los fosfolípidos son menos importantes para los azúcares vitrificados, lo que significa que las membranas en un azúcar vitrificado se comportan de la misma manera ya sea que el azúcar sea trehalosa, sacarosa, glucosa o sorbitol. Los experimentos con POPC (1-palmitoil-2-oleoilfosfatidilcolina, una fosfatidilcolina monosaturada de cadena mixta) mostraron que la deshidratación de POPC en ausencia de azúcares elevaba la Tm de −3ºC a 61ºC . Pero en presencia de cualquiera de las combinaciones de azúcares ensayadas , la Tm nunca superó los 6ºC, independientemente de la cantidad de deshidratación. T men presencia de azúcares vitrificados se redujo a aproximadamente -25ºC, [BIOCHEMICA ET BIOPHYSICA ACTA; Koster,KL; 1193(1):143-150 (1994)].
(Para obtener más información sobre la trehalosa, consulte la crioconservación con azúcares ).
IX. DAÑO POR FRÍO Y CHOQUE POR FRÍO
se refiere al daño inducido en las células mantenidas a temperaturas críticas por debajo de las temperaturas a las que normalmente funcionan las células, mientras queEl choque térmico conduce a un desdoblamiento o desnaturalización bien definido de las proteínas; el choque térmico induce proteínas de choque térmico (chaperonas) para mantener el plegamiento de las proteínas. El choque por frío tiene una gama más amplia de efectos que están menos definidos. El choque por frío se ha estudiado más a fondo con la bacteria Bacillus subtilis . El choque por frío afecta de manera más inmediata los lípidos unidos a la membrana, la conformación de proteínas y la conformación de ácidos nucleicos. Se inhibe la traducción del ARNm . Se inducen proteínas de choque frío y aumenta la síntesis de más ácidos grasos insaturados para aumentar la fluidez de la membrana [ TRANSACCIONES FILOSÓFICAS DE LA SOCIEDAD REAL B; Weber,MWH; 357:895-907 (2002)]. La traducción inicial del ARNm parece ser el punto de control clave para la respuesta al choque por frío en las células de los mamíferos. Se inhibe la actividad enzimática unida a la membrana y se reducen las velocidades de difusión. Las proteínas de choque frío (muy diferentes de las de las bacterias) pueden reclutar ARNm y ribosomas al citoesqueleto para su traducción [ THE BIOCHEMICAL JOURNAL; Al-Fageeh,MB; 397 (parte 2): 247-259 (2006) ].
 |
El daño por frío aumenta con el tiempo de exposición a temperaturas críticas y, de hecho, el enfriamiento rápido a través del rango de temperatura crítica puede ser un medio para reducir el daño por frío [CRIOBIOLOGÍA; Mazur,P; 29(1):39-68 (1992)]. En su innovadora vitrificación de 50 000 células de embriones de Drosophila (embriones ya diferenciados en tejidos y órganos, incluidos músculos y nervios) con etilenglicol, Peter Mazur descubrió que los embriones eran extremadamente sensibles al daño por frío y se volvían cada vez más sensibles a medida que la temperatura bajaba a -25 °C. Un componente crítico para el éxito de la vitrificación de embriones de Drosophila fue superar el daño por frío con velocidades de enfriamiento de al menos 20 000 °C por minuto [ CIENCIA; Mazur,P; 258:1932-1935 (1992)]. Los embriones de peces, que son vulnerables tanto a la sensibilidad al frío como al choque por frío, no pueden criopreservarse mediante un enfriamiento tan rápido [ TERIOGENOLOGÍA; Liu,X; 55(3):1719-1731 (2001) ].
Un mecanismo de lesión por frío en las células animales probablemente se deba a las transiciones de fase en las membranas celulares [ CRYOBIOLOGY 42(2):88-102 (2001) ]. Se esperaría que los lípidos en las membranas celulares experimenten una transición de fase líquida a gel en un rango entre 0ºC y 20ºC, el rango de temperatura de máxima lesión por frío. La sensibilidad al frío se ha reducido en plantas [NATURE 356:710-713 (1992)] y en ovocitos de ovejas [ REPRODUCCIÓN Y DESARROLLO MOLECULAR; cero, Y; 61(2):271-278 (2002) ].
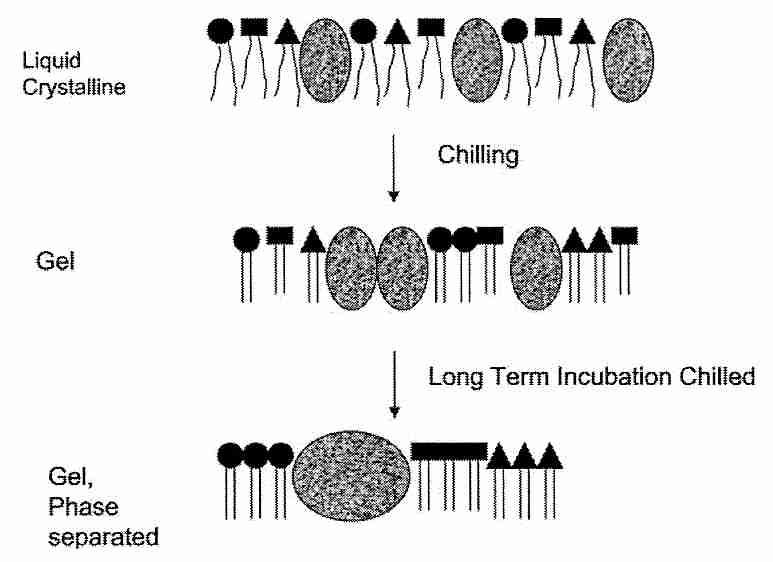
Sin embargo, no se cree que la mayor parte del daño de la membrana asociado con el daño por frío se deba a la fuga asociada con una sola T m (temperatura de transición de fase termotrópica; consulte la sección anterior). La mayor parte del daño por frío se atribuye a la segregación lateral de proteínas y fosfolípidos dentro de las membranas. Los fosfolípidos de la membrana celular son heterogéneos, estando compuestos por diferentes bases en los grupos de cabeza y diferentes ácidos grasos en las colas. Más importante, sin embargo, es la existencia de balsas insolubles en detergente ("plataformas móviles") en las membranas celulares donde hay altas concentraciones de esfingolípidos y colesterol junto con proteínas especializadas [NATURE; Simons, K; 387:569-572 (1997)]. esfingolípidos (las más simples de las cuales son las ceramidas ) se componen de una base esfingoide que tiene cadenas de ácidos grasos altamente saturados. Las enzimas pueden liberar una ceramida en la célula y actuar como una molécula de señalización dentro de la célula. Las ceramidas tienen una T m mucho mayor que los fosfolípidos, lo que contribuye a la disfunción heterogénea de la membrana celular al enfriarse. La separación de fases lateral y la agregación de componentes de lípidos y proteínas durante el enfriamiento interrumpen considerablemente la organización de la membrana.
Las plaquetas son excepcionalmente vulnerables al daño por frío y han servido como modelos para la disfunción inducida por el frío [BIOCHEMICA ET BIOPHYSICA ACTA; Goset, K; 1660(1-2):7-15 (2004)]. Así como el azúcar trehalosa puede reducir el daño por deshidratación, puede proteger las membranas contra el daño por frío de la agregación del injerto mediante enlaces de hidrógeno con grupos de cabeza de fosfolípidos y proteínas [ QUÍMICA Y FÍSICA DE LOS LÍPIDOS; Crowe,JH; 122(1-2):41-52 (2003) ]. Por esta razón, una forma de evitar el daño por frío en la crioconservación ha sido enfriar rápidamente para minimizar el tiempo que se pasa en la región de transición de fase. El daño por frío se ha reducido en embriones de pescado y cerdo mediante la eliminación de lípidos (yema) [ CRYOBIOLOGY 39(3):236-242 (1999) ]. La trehalosa de azúcarreduce la agregación de componentes de membrana posiblemente al unir "microdominios" y, por lo tanto, limitar su movilidad. En la bicapa de fosfolípidos de las membranas celulares, la trehalosa es capaz de desplazar las moléculas de agua unidas a los carbonilos [ BIOPHYSICAL JOURNAL; Amalfa,F; 78(5):2452-2458 (2000) ]. Las células de mamíferos han sido protegidas del daño por congelación y deshidratación con trehalosa al crear poros en las células para permitir la carga de trehalosa [NATURE BIOTECHNOLOGY; Eroglu,A; 18(2):163-167 (2000)], mediante la clonación de un gen transportador de trehalosa facilitado de un insecto [ ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE.UU.); Kikawada,T; 104(28):11585-11590 (2007)] o mediante la transfección de las células con genes que dan a las células la capacidad de síntesis de trehalosa [NATURE BIOTECHNOLOGY; Guo,N; 18(2):168-171 (2000)].
Del mismo modo, la fuga de la membrana se ha aprovechado usando DMSO para facilitar la entrada de trehalosa en las células para la protección de las superficies de la membrana intracelular [DIABETES 46:519-523 (1997)]. La toxicidad del DMSO tras el recalentamiento no debería ser motivo de gran preocupación en las aplicaciones de criónica. De hecho, el daño de la membrana por daño por frío puede afectar la viabilidad mucho más que la estructura general y, por lo tanto, ser menos preocupante en la criónica.
La glicoproteína anticongelante del pescado polar reduce el daño por frío en las plaquetas al inhibir las agregaciones en la membrana, pero la técnica no se puede utilizar clínicamente debido a la dificultad de eliminar las proteínas anticongelantes [ CRYOBIOLOGY 43(2):114-123 (2001) ]: una consideración de menor preocupación para los crionicistas que están más interesados en la preservación de la estructura que en la viabilidad del recalentamiento. El metanol protege a los embriones de pez cebra del daño por frío, un beneficio que se especula que se debe a la posible depresión de las temperaturas de transición de fase en las membranas lipídicas [TERIOGENOLOGÍA; Zhang,T; 59(7):1545-1556 (2003)].
Otra causa de daño por frío (o choque por frío) es la desnaturalización de proteínas. Así como las proteínas se desnaturalizan por calor, las proteínas también pueden desnaturalizarse por enfriamiento. La exposición de las regiones hidrofóbicas de las proteínas se vuelve menos desfavorable desde el punto de vista energético a temperaturas más bajas y, por lo tanto, las proteínas se desplegarán a medida que se bajen las temperaturas. Algunas de las proteínas desnaturalizadas son enzimas antioxidantes, especialmente formas de superóxido dismutasa (SOD), lo que puede explicar por qué se obtiene una mejor supervivencia para la liofilización (secado por congelación) en ausencia de aire. Una vez más, el enfriamiento rápido puede ser un medio eficaz para reducir la desnaturalización de proteínas. Tanto las proteínas de choque térmico como la trehalosa pueden proteger las proteínas y ayudar a reducir el desdoblamiento. Nuevamente, si la lesión es principalmente por enzimas desnaturalizantes,
Aunque la sensibilidad al frío se ha reducido en las plantas al aumentar el grado de insaturación de los ácidos grasos [NATURE 356:710-713 (1992)], gran parte del daño por frío (o choque por frío) en las plantas se ha atribuido al daño de los radicales libres [JOURNAL OF QUÍMICA AGRÍCOLA Y ALIMENTARIA 47:2410-2414 (1999)]. También se ha observado evidencia de daño por radicales libres durante el enfriamiento en moscas domésticas [ CRIOBIOLOGÍA 33(4):447-458 (1996) ] y esperma (las membranas espermáticas tienen un alto contenido de ácidos grasos poliinsaturados) [ REPRODUCCIÓN Y DESARROLLO MOLECULAR; Neild, DM; 72(2):230-238 (2005) ].
Se ha demostrado el desacoplamiento de la síntesis de ATP de las enzimas mitocondriales de la cadena de transporte de electrones por enfriamiento (o choque frío), y coincidente con el aumento del estrés oxidativo hay una reducción de la actividad de la enzima antioxidante debido al enfriamiento. La enzima antioxidante catalasa muestra una marcada disminución en la actividad con la disminución de la temperatura, mientras que la actividad de la peroxidasa permanece sin cambios, lo que resulta en la acumulación de peróxido de hidrógeno. Las plantas tolerantes al frío muestran mayores niveles de producción de catalasa con la disminución de la temperatura. El aumento de la entrada de calcio puede activar las fosfolipasas que descomponen las membranasmediante la liberación de ácidos grasos. Se ha demostrado que la exclusión de aire (oxígeno) reduce el daño por frío en plantas e insectos. Los radicales libres pueden destruir la estructura si se les permite operar durante períodos prolongados. Parece probable que el daño por frío debido a los radicales libres también deba ocurrir en cierta medida en los tejidos de los mamíferos debido a la isquemia por frío, así como mecanismos similares a los observados en las plantas. El oxígeno es más soluble en agua a baja temperatura, lo que contribuye al daño a baja temperatura por especies reactivas de oxígeno. La trehalosa protege a las células y proteínas del daño oxidativo, mientras que la sacarosa no lo hace [ JOURNAL OF BIOLOGICAL CHEMISTRY; Benaroudj,N; 276(26):24261-24267 (2001) ].
La polimerización de los microtúbulos en los ovocitos es muy sensible a la temperatura y la despolimerización completa de los microtúbulos puede ocurrir justo por encima de los 0ºC [ BIOLOGÍA DE LA REPRODUCCIÓN; Amán,RR; 50(1):103-110 (1994) ]. En algunos casos, la repolimerización del huso meiótico ocurre con el recalentamiento [ FERTILIDAD Y ESTERILIDAD; Ciotti, PM; 91(6):2399-2407 (2009) ], pero en otros casos quedan configuraciones cromosómicas irregulares y organización anormal de tubulina después del recalentamiento [ FERTILITY AND STERILITY; Songsasen,N; 77(4):818-825 (2002) ].
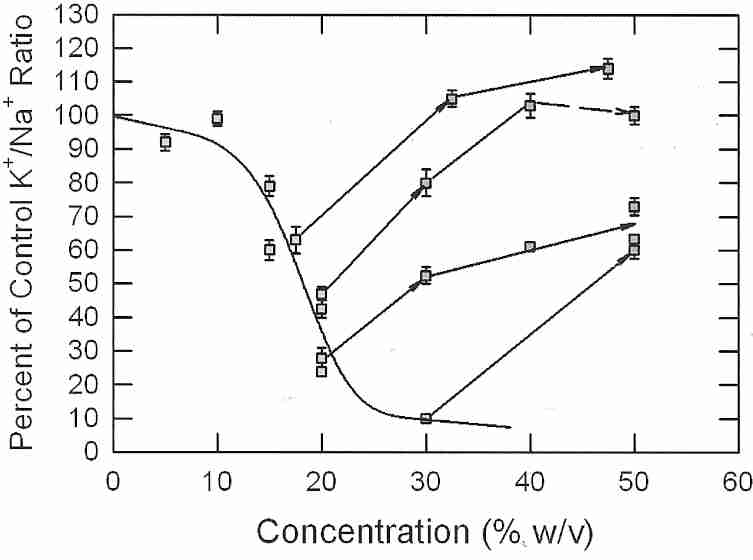
Se han llevado a cabo experimentos de enfriamiento de cortes corticales de riñón de conejo en solución de vitrificación en los que se utilizó la viabilidad (proporción K + /Na + ) como índice del daño por frío (o shock por frío) que han indicado un aumento lineal del daño por frío de 0ºC a -85ºC . Parece poco probable que la transición de fase lipídica sea responsable de esta lesión por frío. Las soluciones hipertónicas en el rango de 1,2 a 1,5 veces la isotonicidad eliminaron por completo el daño por frío entre 0ºC y −22ºC. El daño por frío hasta -135 ºC se minimizó (85-90 % de viabilidad) enfriando hasta -22 ºC con una hipertonicidad de 1,2X y enfriando más hasta -135 ºC con una hipertonicidad de 1,5X [CRIOBIOLOGÍA; Fahy, GM; 48(2):157-178 (2004)]. El encogimiento de las células evidentemente las protege contra el daño por frío.
X. ESTÁNDARES PARA LA INVESTIGACIÓN EN CRIONICA
La investigación con criónica ha estado utilizando las proporciones intracelulares de K + /Na + (proporción potasio-sodio) para evaluar la efectividad de las fórmulas de vitrificación. Si las proporciones intracelulares de K + /Na + son normales después de la aplicación de crioprotector y/o enfriamiento seguido de recalentamiento, eso sería una indicación de que las membranas celulares no se han roto por la formación de hielo. Las membranas dañadas darían proporciones intracelulares de K + /Na + equivalentes a las del líquido extracelular. Pero el K + /Na + intracelular Las proporciones también deberían ser un índice de viabilidad, porque si el crioprotector ha envenenado una célula y la ha matado, no puede haber producción de ATP o funcionalidad de la bomba de sodio.
Cuando las muestras de tejido se exponen a crioprotectores y bajas temperaturas, el bombeo de sodio se incapacita y las proporciones intracelulares de K + /Na + se aproximan a los niveles extracelulares como resultado de la fuga de iones. Si la vitrificación ha sido efectiva, cuando los tejidos se recalientan y el crioprotector se elimina por lavado, la bomba de sodio restablecerá la proporción normal de K + /Na + . Para permitir que ocurra este proceso, las rebanadas de tejido se incuban en medios de crecimiento oxigenados tibios. En 40-60 minutos, los cortes de tejido alcanzarán proporciones de K + /Na + en proporción a su viabilidad (por definición). Así, si el tejido recupera el 85% del K + /Na intracelular normal+ relación se dice que es 85% viable. Este índice de viabilidad mide tanto la funcionalidad de la bomba de sodio como la capacidad de generación de ATP mitocondrial, sin distinguir cuál está siendo afectada. El envenenamiento de las bombas de sodio tisulares con uabaína dará como resultado proporciones intracelulares de K + /Na + tisulares iguales a las del entorno en unos 30 minutos.
La mayor ventaja del ensayo K + /Na + es que es económico y más fácil de medir que el daño estructural que se observa en las micrografías. Los ensayos son cuantitativos y se pueden obtener rápidamente. Sin duda, es menos costoso que tomar micrografías electrónicas (EM), aunque este último es el estándar definitivo para la ausencia de daños estructurales debido al hielo. Ambos K + /Na + Las proporciones y los EM (medidas de viabilidad e integridad estructural) requieren recalentamiento (y posible desvitrificación). Si fuera económicamente factible evaluar la estructura histológica a -130 ºC (la criohistología no requiere recalentamiento), eso daría la mejor evaluación de la calidad de la preservación estructural en el almacenamiento a largo plazo. No obstante, la ausencia de daño estructural ciertamente se afirma si las muestras se recalientan sin vitrificación para preparaciones histológicas que no muestran daño por hielo.
Otra herramienta para evaluar la vitrificación (ausencia de formación de hielo y, por lo tanto, ausencia de daño estructural debido al hielo) es el Calorímetro de Barrido Diferencial ( DSC ), que puede detectar "firmas térmicas" de formación de hielo y transición vítrea en pequeñas muestras de tejido (1 mg a 10 mg). El criobiólogo Pierre Bouton utilizó una formación de hielo del 0,5 % como límite inferior del daño estructural, pero Medicina del siglo XXI (21CM) utiliza la cifra más estricta del 0,2%. (De hecho, no existe una prueba definitiva para ninguna de las cifras, aunque ciertamente la formación de hielo del cero por ciento daría como resultado un daño cero debido al hielo). Así como se pueden tomar muestras pequeñas y recalentarlas para EM, se pueden tomar muestras pequeñas y recalentarlas para DSC. análisis. Aunque DSC tiene la ventaja de ser cuantitativo, sigue siendo un indicador menos definitivo de la ausencia de daño estructural que los EM siempre que la formación de hielo sea mayor que cero.
El hecho de la lesión o la pérdida de viabilidad a menudo no es útil para determinar la fuente de esa lesión. Se pueden producir lesiones durante la carga del crioprotector, durante el enfriamiento, durante el recalentamiento o durante la descarga del crioprotector. El daño por frío, el daño osmótico, la toxicidad por crioprotectores y la desvitrificación reducen la viabilidad. Las neuronas pueden perder la viabilidad, pero no las células gliales, lo que enmascara la pérdida de viabilidad de las neuronas, aunque las micrografías electrónicas son útiles para determinar si se están dañando distintos tipos de células. Conocer la fuente de la lesión es de importancia crítica en la búsqueda de un remedio y, a menudo, ni los ensayos de K + /Na + ni las micrografías electrónicas son útiles en este sentido. DSC, sin embargo, puede ser útil para identificar T mvalores y daño por frío asociado [CRIOBIOLOGÍA; Hayes,LM; 42(2):88-102 (2001)].
En mi opinión, la investigación en criónica debería usar ensayos de K + /Na + como la primera prueba de eficacia crioprotectora y protocolo de criónica. Las proporciones de K + /Na + que son del 40% de lo normal indicarán membranas intactas (ausencia de daño estructural) incluso si la viabilidad es baja. Luego, se debe hacer hincapié en DSC (cuando sea factible), micrografías de luz (LM) y, en última instancia, EM. Solo después de lograr EM perfectos podemos estar seguros de que se ha eliminado el daño estructural. En ese momento tendríamos el lujo de volver a poner el énfasis en las relaciones K + /Na + encaminadas a obtener relaciones K + /Na + cercanas al 100% de lo normal (viabilidad total).
XI. APÉNDICE: EJEMPLOS DE CÁLCULOS DE qv*
1,3-propanodiol en RPS-2
La Tabla 1 de Cryobiology 21:407 (1984) da la concentración necesaria para vitrificar 1,3-propanodiol como 57% p/v, por lo que asumo que tenemos 57 gramos de 1,3-propanodiol en el RPS-2 (Renal Solución de perfusión dos) solución portadora. * indica multiplicación y / indica división.
La densidad del 1,3-propanodiol es 1,0597 g/ml, por lo que el volumen de 1,3-propanodiol en 100 ml de solución es
57 * (1/1,0597) = 53,79 mililitros ( ml )
más 2,00 mL de componentes RPS-2 [de la Tabla 2 de Cryobiology 48:22 (2004)] da 55,79 mL
Por lo tanto el volumen de agua es
100 ml − 55,79 ml = 44,21 ml
La densidad del agua es de 1 g/ml y la masa molar del agua es de 18,015 g/mol.
Por lo tanto 44.21 gramos de agua son
44,21 g * (1/18,015 g/mol) = 2,454 moles de agua
La masa molar del 1,3-propanodiol es 76,09 por lo que tenemos
57 g * (1/76,09) = 0,7491 moles de 1,3-propanodiol
Hay dos grupos polares por molécula de 1,3-propanodiol
Por lo tanto, por 100 mL de solución tenemos:
qv* = M w /M pg = 2,454/(2*0,7491) = 1,64
que está cerca del valor de 1,6 que se muestra en la Tabla 1 de la patente 6.395.467
EG, PG y PVP en RPS-2
Este es un cálculo de qv* para la solución 14 de la Tabla 1 de Cryobiology 48:22 (2004). La solución 14 consta de partes iguales de etilenglicol ( EG ) y propilenglicol ( PG ) en una solución al 6 % de polivinilpirrolidona ( PVP ) en solución portadora RPS-2 (solución de perfusión renal dos).
(En este cálculo, permito que se acumulen los decimales y hago el redondeo al final. * indica multiplicación y / indica división).
El valor de la concentración necesaria para vitrificar la solución 14 se muestra como 46% p/v en la Tabla 1 de Cryobiology 48:22 (2004).
Para la solución 14 hay 20 gramos de EG, 20 gramos de PG y 6 gramos de PVP en RPS-2 por cada 100 mililitros ( mL ) de solución
La densidad de EG es 1.1132 gm/mL por lo tanto el volumen es
20 ml * (1/1,1132 g/ml) = 17,9662 ml
La densidad de PG es 1.036 gm/mL por lo tanto el volumen es
20 ml * (1/1,1036 g/ml) = 19,305 ml
La densidad de PVP es 1,28 g/mL o 0,782 mL/g según la Tabla 2, por lo que el volumen es
6 ml * 0,782 ml/g = 4,692 ml
Los componentes sólidos de RPS-2 de la Tabla 2 tienen un volumen de 2,00 ml
Por lo tanto, el volumen total de EG+PG+PVP+RPS-2 es
17,9662 ml + 19,305 ml + 4,696 ml + 2,00 ml = 43,9672 ml
Por lo tanto el volumen de agua es
100 ml − 43,9672 ml = 56,0328 ml
Esto implica la suposición simplificadora de que si agrega 17,9662 ml de EG a 19,305 ml de PG, 4,696 ml de PVP y RPS-2, obtiene 100 ml de solución, lo que en la práctica no suele suceder, aunque es más o menos exacto.
La densidad del agua es de 1 g/ml y la masa molar del agua es de 18,015 g/mol.
Por lo tanto 56.0328 gramos de agua son
56,0328 g * (1/18,015 g/mol) = 3,11034 moles de agua
Las masas molares de EG, PG y PVP son 62.068, 79.06 y 40.000 respectivamente, por lo tanto tenemos
20 g * (1/62,068 g/mol) = 0,332956 moles EG
20 g * (1/79,06 g/mol) = 0,252972 moles PG
6 g * (1/40 000 g/mol) = 0,00015 moles de PVP
Hay dos grupos polares por molécula de EG y PG, pero no tengo ni idea de cuántos grupos polares hay por molécula de PVP. Si fuera 1 grupo polar en PVP (muy poco probable), el efecto de PVP sería insignificante. En la medida en que no tenga un valor para los grupos polares PVP, lo ignoraré y asumiré que el número de moles de los grupos polares es igual al número de moles de los grupos polares EG. La PVP es una molécula demasiado grande para penetrar las membranas celulares, por lo que asumo que solo los crioprotectores penetrantes son relevantes.
(0,332956 moles EG + 0,252972 moles PG) * 2 = 1,17186 moles grupos polares
Por lo tanto, por decilitro de solución tengo:
qv* = (moles de agua)/(moles de grupos polares) = M w /M pg = 3,11034/1,17186 = 2,6542
que está cerca del valor de 2,67 que se muestra en la Tabla 1 de Cryobiology 48:22 (2004).
 diciembre 16, 2022
diciembre 16, 2022
 Posted in:
Posted in: 
