(Para un enfoque más cuantitativo menos relacionado con la biología molecular, consulte Cuantificación del daño isquémico para el rescate con criónica ).
CONTENIDOS: ENLACES A SECCIONES POR TEMA
- NOTAS INTRODUCTORIAS
- LESIÓN ISQUÉMICA EN EL CEREBRO Y EN OTRAS PARTES
- LESIÓN POR REPERFUSIÓN Y "NO REFLOW"
- TERAPIA DEL ACV
- HIBERNACIÓN Y ESTIVACIÓN
- SOLUCIÓN DE TRASPLANTE DE ÓRGANOS
- DAÑO CEREBRAL POR ISQUEMIA/REPERFUSIÓN
- PREVENCIÓN DE LESIONES ISQUÉMICAS/REPERFUSIÓN EN CRYONICS
- PRETRATAMIENTO PARA PACIENTES CRYONICS
- CONCLUSIONES
I. OBSERVACIONES INTRODUCTORIAS
La isquemia es la condición que sufren los tejidos y órganos cuando se les priva del flujo sanguíneo, principalmente los efectos de nutrientes y oxígeno inadecuados. La lesión por reperfusión se refiere al daño tisular infligido cuando se restablece el flujo sanguíneo después de un período isquémico de más de aproximadamente diez minutos. La isquemia y la reperfusión pueden causar daño cerebral grave en caso de accidente cerebrovascular o paro cardíaco. Los pacientes de criónica experimentan con frecuencia lesiones isquémicas y por reperfusión entre el momento en que el corazón se detiene y comienza el crioalmacenamiento.
En este artículo, intento evaluar la naturaleza y el alcance de la lesión isquémica y por reperfusión, centrado principalmente en el impacto de la criónica (aunque ciertamente relevante para el accidente cerebrovascular y el paro cardíaco). También intento evaluar qué se puede hacer para minimizar dicho daño. Enfoco mi atención en la lesión por isquemia/reperfusión en el cerebro. Confío en artículos de revistas revisadas por pares para obtener información. El artículo más completo que he encontrado sobre lesiones isquémicas y por reperfusión es "Ischemic Cell Death in Brain Neurons" de Peter Lipton [ PHYSIOLOGICAL REVIEWS; 79(4):1431-1568 (1999) ]. La mayoría de las declaraciones fácticas sin referencia que hago se basan en la revisión de Lipton.
 |
II. LESIÓN ISQUÉMICA EN EL CEREBRO Y EN OTRAS PARTES
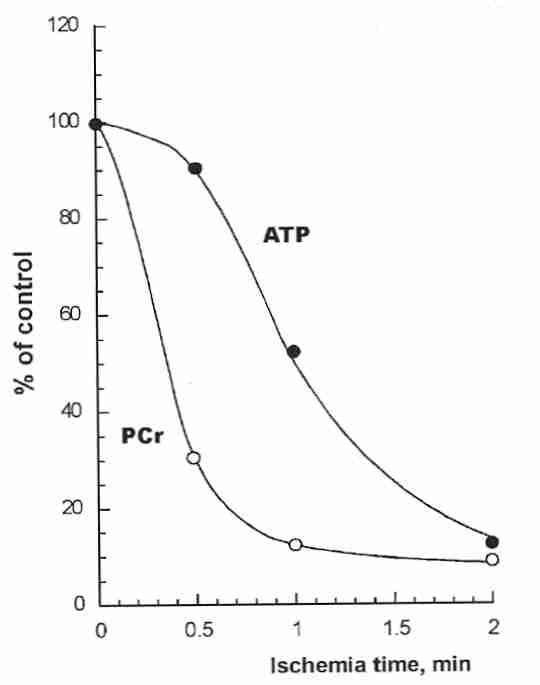
La mayor parte de la energía metabólica de las neuronas se gasta en mantener los gradientes iónicos a través de la membrana celular. Una bomba de sodio/potasio (Na + /K + ) mantiene el potasio extracelular bajo y el sodio extracelular alto en comparación con las concentraciones intracelulares. Esta bomba es impulsada por la energía almacenada en las moléculas de ATP (trifosfato de adenosina) fabricadas en las mitocondrias. La mayor parte de la energía (ATP) generada en las mitocondrias requiere oxígeno, pero en ausencia de oxígeno se puede generar algo de energía en el citoplasma fuera de las mitocondrias mediante la glucólisis , en la que una molécula de glucosa produce dos moléculas de ATP y lactato. La liberación de fosfato a partir de ATP es una fuente de energía celular que da como resultado ADP(Difosfato de adenosina) e iones de hidrógeno (ácido).
En el primer minuto después de la interrupción del flujo sanguíneo al cerebro, el ATP en las neuronas se regenera principalmente a partir del ADP mediante el fosfato de la fosfocreatina ( PCr ). En dos minutos sin flujo sanguíneo (debido a un paro cardíaco oa la oclusión de un vaso sanguíneo), las neuronas carecen de energía para impulsar la bomba de sodio/potasio. Los iones de potasio salen rápidamente de la célula mientras que los iones de sodio y cloruro entran rápidamente a medida que las membranas celulares se despolarizan. La descomposición neta de ATP de la glucólisis da como resultado ADP, AMP (monofosfato de adenosina), fosfato, lactato y acumulación de ácido (acidosis). La acumulación de dióxido de carbono da como resultado ácido carbónico (H 2 CO 3), lo que aumenta aún más la acidez. A los dos minutos de la isquemia, el pH extracelular puede descender desde alrededor de 7,3 hasta alrededor de 6,7.
Otra bomba impulsada por ATP ayuda a mantener los iones de calcio extracelulares (Ca 2+ ) 10 000 veces más concentrados que dentro del citoplasma. Los canales iónicos activados por voltaje y los intercambiadores de iones en la membrana celular también regulan las concentraciones de iones.![[ILUSTRACIÓN DE SINAPSIS NMDA]](https://benbest.com/cryonics/AmpaNmda.gif)
La despolarización de las membranas presinápticas da como resultado la liberación del neurotransmisor glutamato (ácido glutámico) . Las membranas postsinápticas contienen varios tipos de receptores de glutamato, en particular los receptores NMDA y AMPA, que permiten la entrada de iones de calcio. Las membranas postsinápticas contienen dos canales de calcio dependientes de voltaje (tipo L y tipo T), así como un intercambiador de sodio/calcio, pero el canal NMDA es particularmente hábil para permitir que grandes cantidades de iones de calcio entren en la célula. La liberación excesiva de glutamato que da como resultado una entrada excesiva de Ca + 2 en las células es la excitotoxicidad que inicia el daño isquémico cerebral que se observa en el accidente cerebrovascular y el paro cardíaco.
En tiempos de alta demanda metabólica y disponibilidad adecuada de oxígeno, el calcio elevado en las mitocondrias puede aumentar la producción de ATP mediante la estimulación de tres enzimas en el ciclo del ácido cítrico de Krebs: piruvato deshidrogenasa, alfa-cetoglutarato e isocitrato deshidrogenasa. Pero cuando el oxígeno no está disponible en cantidades adecuadas para aceptar electrones (átomos de hidrógeno) del NADH, el exceso de electrones forma superóxido a partir del oxígeno residual. Al contrarrestar la producción de NADH, la acción del calcio sobre los poros de transición de la permeabilidad mitocondrial aumenta la permeabilidad de la membrana interna, lo que reduce el potencial de protones, lo que hace que la matriz se hinche y finalmente libere el citocromo c (un iniciador de la apoptosis).
Los altos niveles de iones de calcio intracelulares activan las enzimas proteolíticas (conocidas como calpaínas) que descomponen muchas proteínas celulares, particularmente aquellas en el citoesqueleto de las neuronas (espectrina, neurofilamento y proteína asociada a microtúbulos). El hecho de que los pacientes con enfermedad de Alzheimer tengan el triple de los niveles normales de calpaína en su corteza prefrontal podría indicar un papel de la isquemia como causa de la enfermedad [ ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE.UU.); 90(7):2628-2632 (1993) ]. Las endonucleasas nucleares activadas por calcio pueden escindir la cromatina y comenzar el proceso de apoptosis ("suicidio celular").
Los iones de calcio también activan las enzimas fosfolipasas que atacan los fosfolípidos de la membrana celular y provocan la liberación de ácido araquidónico. Los inhibidores de las enzimas lipoxigenasa y ciclooxigenasa (que descomponen el ácido araquidónico en eicosanoides como la prostaglandina) pueden reducir los déficits cerebrales causados por la isquemia [CRITICAL REVIEWS OF NEUROBIOLOGY 15(1):61-90 (2003)]. (Para obtener más información sobre la fosfolipasa, los eicosanoides, etc., consulte Ácidos grasos esenciales en las membranas celulares ).
La mayor parte del daño cerebral isquémico ocurre en la porción lipídica de las membranas celulares a través de la peroxidación lipídica y la actividad de la fosfolipasa. La isquemia cerebral da como resultado una liberación rápida de ácidos grasos (especialmente ácido araquidónico) debido a las enzimas fosfolipasas. La fosfolipasa A 2 citoplasmática dependiente de calcio ( cPLA 2 ) se activa por la entrada de Ca + 2 en las células después de unos minutos de isquemia. cPLA 2 libera preferentemente ácido araquidónico oxidado (que está presente en grandes cantidades en las membranas neurales). Las enzimas lipoxgenasas forman hidroperóxidos de lípidos (ROOH) que pueden conducir a la peroxidación de lípidos mediante reacciones similares a las de Fenton [BIOLOGICAL CHEMISTRY 383:365-374 (2002)]. El propio ácido araquidónico tiene un efecto desacopladorsobre las mitocondrias además de su inhibición directa de las enzimas respiratorias mitocondriales y la promoción de la formación de radicales libres [FREE RADICAL BIOLOGY AND MEDICINE 27(1-2):51-59 (1999)].
La energía celular baja y las membranas dañadas reducen la absorción de glutamato, lo que empeora la excitotoxicidad. Pronto, el daño de la membrana neuronal es tan grande que el principal mecanismo de liberación de glutamato es la fuga directa a través de las membranas celulares [BRAIN RESEARCH BULLETIN 34(5):457-466 (1994)]. La enzima grande (peso molecular 140 000) lactato deshidrogenasa (LDH) pronto se ve filtrada a través de las membranas dañadas por la isquemia. Los niveles de LDH en sangre o tejido se han utilizado a menudo como un indicador del daño celular debido a una lesión por isquemia/reperfusión. La LDH es muy adecuada como ensayo para la lisis celular porque existe en una concentración relativamente alta en todas las células y es estable.
tercero LESIÓN POR REPERFUSIÓN Y "NO REFLOW"
El reinicio inmediato de la circulación después de la isquemia puede prevenir el daño tisular. Reanudar el flujo sanguíneo después de más de diez minutos de isquemia suele ser más perjudicial que la isquemia en sí porque la isquemia prepara el escenario para que el oxígeno genere radicales libres en lugar de contribuir a la producción de energía celular [ INVESTIGACIÓN CARDIOVASCULAR; Zweier,JL; 70(2):181-190 (2006) ]. Además de los radicales libres generados por el oxígeno, las citoquinas pueden ser una fuente importante de daño por reperfusión [ EMEDICINE; Elzawahry,H; (24 de junio de 2009) ]. De dos a seis horas de isquemia seguidas de 24 horas de reperfusión más del triple del volumen del infarto [ JOURNAL OF CEREBRAL BLOOD FLOW & METABOLISM; Aronowski,J; 17(10):1048-1056 (1997)]. En la sección uno de [ INVESTIGACIÓN CARDIOVASCULAR; Zweier,JL; 70(2):181-190 (2006) ].
La acidez producida por la isquemia reduce en gran medida la liberación de ácido araquidónico de las membranas celulares por parte de las fosfolipasas, por lo que la actividad de las fosfolipasas
Durante el período isquémico hay una acumulación de ácido láctico que baja el pH celular. Las células utilizan el intercambio Na + /H + para eliminar el exceso de protones, pero en el proceso acumulan un exceso de Na + que no puede ser exportado con la bomba de sodio (Na-K-ATPasa) debido a la deficiencia de ATP. Como consecuencia, las células utilizan el intercambio Na + /Ca + 2 , que carga las células con Ca + 2 . Tras la reperfusión, el Ca +2 entra en la mitocondria , pero el poro de transición de la permeabilidad mitocondrial ( MPTP )permanece cerrado porque la acidez mantiene el cierre MPTP. La elevación del pH con reperfusión puede abrir la MPTP [TRANSACCIÓN DE LA SOCIEDAD BIOQUÍMICA; Halestrap, AP; 34 (Pt 2): 232-237 (2006)]. Si el MPTP puede cerrarse o si ATP puede generarse de otro modo, las células morirán por apoptosis. Sin suficiente ATP, la apertura del MPTP produce necrosis [COMUNICACIONES DE INVESTIGACIÓN BIOQUÍMICA Y BIOFÍSICA; Kim,J; 304(3):463-470 (2003)].
La NAD(P)H oxidasa en reperfusión reacciona con el oxígeno recién introducido para producir superóxido [ STROKE; Kahles,T; 38(11):3000-3006 (2007) ]. El superóxido reacciona con las proteínas de hierro y azufre, disminuyendo su actividad y liberando hierro libre, lo que provoca la formación de radicales hidroxilo. El óxido nítrico en las mitocondrias reacciona con el superóxido tres veces más rápido que la superóxido dismutasa (SOD). El superóxido reacciona con el óxido nítrico más eficientemente que con cualquier otra molécula, consumiendo rápidamente el óxido nítrico para formar el potente radical libre peroxinitrito [ JOURNAL OF APPLED FISIOLOGY; Faraci, FM; 100(2):739-743 (2006) ]. El peroxinitrito inactiva irreversiblemente no solo la SOD, sino también los complejos I y II de la cadena respiratoria mitocondrial.
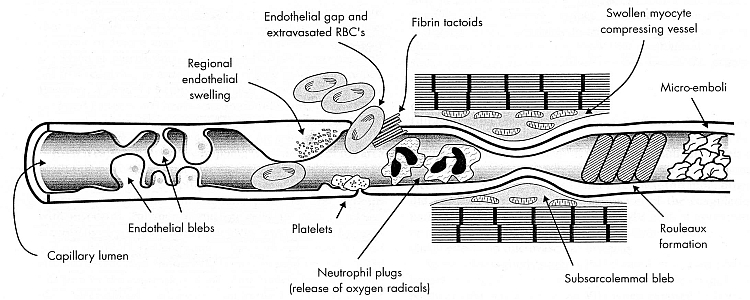
En la reperfusión se produce un daño considerable de la membrana de las células endoteliales, así como de las plaquetas, los leucocitos y otras células del torrente sanguíneo. Los neutrófilos activados producen superóxido, que puede dismutarse en peróxido de hidrógeno. La enzima mieloperoxidasa de neutrófilos convierte el peróxido de hidrógeno en ácido hipocloroso. El ácido hipocloroso que reacciona con el superóxido puede producir radicales hidroxilo. La agregación de glóbulos rojos cerca de la salida de los capilares empuja a los leucocitos contra las células endoteliales, lo que aumenta la adhesión de los leucocitos [ AMERICAN JOURNAL OF FISIOLOGÍA; Pearson,MJ; 279(4):H1460-H1471 (2000) ]. La adhesión de leucocitos (y el daño por reperfusión) es mayor en animales de mayor edad [MICROCIRCULACIÓN; Ritter,L; 15(4):297-310 (2008)].
Los eicosanoides generados por el ácido araquidónico (especialmente los leucotrienos) aumentan en gran medida la adhesión de leucocitos y plaquetas a las paredes de los capilares, obstruyéndolos. El superóxido también aumenta la adhesión de los leucocitos a las paredes de los vasos. La adhesión de los leucocitos también es potenciada por la proteína InterCellular Adhesion Molecule 1 ( ICAM-1 ) liberada de las membranas de las células endoteliales y los leucocitos por las citoquinas durante la reperfusión (un efecto atenuado por la hipotermia) [ ACV; Ishikawa,M; 30(8):1679-1686 (1999) ]. Los eicosanoides (leucotrienos y prostaglandinas) y los radicales libres de oxígeno asociados hacen que las paredes de los capilares sean más "permeables", provocando un edema que estrecha los canales. El agotamiento de ATP reduce significativamente la capacidad de los eritrocitos para deformarse.LA REVISTA DE INVESTIGACIÓN CLÍNICA; maleza, RI; 48(5):795-809 (1969) ]. Estos efectos se vuelven rápidamente lo suficientemente pronunciados en la reperfusión como para bloquear los capilares por completo: el fenómeno de no reflujo . La oclusión experimental de la arteria cerebral media ha mostrado una reducción del flujo sanguíneo al 71 % del control después de una oclusión de una hora y una reducción al 22 % del control después de una oclusión de cuatro horas [BRAIN RESEARCH; Dawson,DA; 749:200-208 (1997)]. La corteza cerebral, la parte del cerebro en la que se supone que reside la conciencia , es afortunadamente menos vulnerable al reflujo que otras áreas del cerebro. Se ha demostrado que más del 50 % de los vasos sanguíneos están ocluidos en el tálamo y los ganglios basales después de 30 minutos de isquemia, pero menos del 15 % de los vasos en la corteza cerebral están ocluidos.CARRERA; Fischer,EG; 3(5):538-542 (1972) ].
Pero el reflujo puede ocurrir incluso sin glóbulos. Los radicales libres y otros daños en la membrana pueden aflojar o desalojar la placa aterosclerótica y causar émbolos tras la reperfusión.
 |
El óxido nítrico normalmente funciona no solo para reducir la agregación de plaquetas y la adhesión de leucocitos al endotelio, sino también para promover la relajación del músculo liso vascular y reducir la producción de citoquinas en las células endoteliales. El óxido nítrico se concentra en las regiones celulares lipofílicas con un coeficiente de partición de 8:1 y puede inhibir la peroxidación lipídica mil veces más potente que el alfa-tocoferol [ JOURNAL OF BIOLOGICAL CHEMISTRY; Rubio,H; 269(42):26066-26075 (1994) ]. El óxido nítrico potencia la transcripción de las enzimas de desintoxicación de fase 2 (incluidas las enzimas antioxidantes ) [ JOURNAL OF BIOLOGICAL CHEMISTRY;Dhakshinamoorthy,S; 279(19):20096-20107 (2004)]. El óxido nítrico inhibe la expresión de genes proinflamatorios por el factor de transcripción NF-kappaB [TRANSPLANTATION PROCEEDINGS 30:4239-4243 (1998)]. NF-kappaB activa la citocina TNF-α para aumentar la expresión de moléculas de adhesión celular. El óxido nítrico inhibe la apoptosis mediante la inhibición de la enzima caspasa-3 [ JOURNAL OF BIOLOGICAL CHEMISTRY; Rossig,L; 274(11):6823-6826 (1999) ]. Pero estas acciones beneficiosas del óxido nítrico se observan en ausencia de isquemia/reperfusión, que convierte el óxido nítrico en una toxina.
Los niveles sanguíneos elevados de la citocina proinflamatoria TNF-α inducen la apoptosis [COMUNICACIONES DE INVESTIGACIÓN BIOQUÍMICA Y BIOFÍSICA; Bajaj,G; 345(4):1558-1564 (2006)]. En condiciones inflamatorias, como ocurre en la reperfusión, la óxido nítrico sintetasa inducible puede aumentar la concentración de óxido nítrico a miles de veces los niveles normales [BIOLOGÍA Y MEDICINA DE RADICALES LIBRES; Marrón,GC; 33(11):1440-1450 (2002)]. Durante la reperfusión, cantidades anormalmente altas de superóxido convierten casi todo el óxido nítrico disponible en perxonitrito, considerado como el agente que causa la mayor parte del daño a las células endoteliales de los capilares cerebrales [NEUROSURGERY 43(3):577-584 (1998)]. En un estudio, la inhibición del peroxinitrito reactivo resultante de la reperfusión después de 30 minutos de isquemia caliente duplicó la recuperación de la función contráctil.REVISTA DE QUÍMICA BIOLÓGICA; Wang,P; 271(46):29223-29230 (1996) ]. El daño al endotelio no solo aumenta el edema (hinchazón del tejido debido a la "permeabilidad"), sino que también provoca protuberancias endoteliales ("ampollas") que pueden bloquear los capilares.
La isquemia en los tejidos y los vasos sanguíneos hace que grandes cantidades de ATP se descompongan en xantina . La reperfusión permite que la enzima endotelial xantina oxidasa convierta la xantina más el oxígeno en superóxido y ácido úrico. Los iones de hierro y zinc liberados aumentan aún más el daño de los radicales libres. En contraste con la vasculatura, las mitocondrias en los tejidos, en lugar de la xantina oxidasa, son la principal fuente de radicales libres de oxígeno durante la lesión por reperfusión [ JOURNAL OF CLÍNICAL INVESTIGATION; 91(2):456-464 (1993) ]. Pero el daño del superóxido producido por la xantina oxidasa (y el peroxinitrito resultante) a las células endoteliales puede ser el principal modo de daño por reperfusión, con mucho menos daño a las células parenquimatosas y mucho menos daño debido a los neutrófilos [CIRUGÍA; Rátych,RE; 102(2):122-131 (1987)].
Existe una correlación lineal entre la cantidad de lesión por reperfusión y la interrupción de la barrera hematoencefálica ( BBB ). El flujo de agua hacia el cerebro debido a la interrupción de BBB puede provocar edema . El daño adicional de BBB puede transformar un accidente cerebrovascular isquémico en un accidente cerebrovascular hemorrágico. Las proteasas (enzimas que degradan las proteínas) se liberan en la isquemia [ ACV; Fukuda,S; 35(4):998-1004 (2004) ]. Matrix MetaloProteinase-13 ( MMP-13 , una colagenasa ) que se origina de una fuente desconocida al principio de la isquemia ejerce un efecto corrosivo en la barrera hematoencefálica [ STROKE; Rosell,A; 36(7):1415-1420 (2005)], pero a diferencia de otras MMP no continúa aumentando en cantidad con el tiempo [ STROKE; Horstmann,S; 34(9):2165-2170 (2003) ]. Los leucocitos (probablemente neutrófilos) activados por la inflamación isquémica liberan cantidades crecientes de MMP-9 ( gelatinasa-B ) que también degrada la barrera hematoencefálica [ AMERICAN JOURNAL OF PHYSIOLOGY; Gidday,JM; 289(2):H558-H568 (2005) ]. Sin embargo, antes de la activación de los procesos inflamatorios isquémicos, la reperfusión puede activar la gelatinasa A ( MMP-2 ), que aumenta la permeabilidad capilar y la hemorragia, además de abrir la barrera hematoencefálica [ STROKE; Rosenberg,GA; 29(10):2189-2195 (1998) ].
(Para obtener más información sobre "Sin reflujo", consulte Reducción de "Sin reflujo" . Para obtener más información sobre el daño por isquemia/reperfusión en la barrera hematoencefálica que conduce a edema, consulte Edema en criónica ).
IV. TERAPIA DEL ACV
¿Pueden los fármacos ayudar a prevenir el daño isquémico en pacientes con criónica? Un estudio de la literatura sobre la terapia del accidente cerebrovascular es instructivo.
Uno podría pensar que los medicamentos que bloquean la entrada de iones de calcio a través de los receptores NMDA serían beneficiosos para el accidente cerebrovascular, pero los ensayos clínicos con estas sustancias han sido un fracaso. Aunque los estudios en animales muestran que los bloqueadores de NMDA son efectivos durante los primeros 4 minutos, después de 8 minutos, los niveles intracelulares de iones de calcio son los mismos, ya sea que se usen bloqueadores de NMDA o no. Los bloqueadores del canal L (como la nimodipina) no hacen ninguna diferencia.
Hay razones plausibles por las que los bloqueadores de NMDA, incluso cuando se combinan con bloqueadores del canal L, tienen una utilidad limitada para prevenir la entrada de calcio en las células isquémicas. Los niveles bajos de ATP significan una capacidad reducida de la bomba de calcio-ATP para mantener el calcio fuera de la célula. El sodio citoplasmático alto significa una actividad alta de los intercambiadores de sodio/calcio de la membrana, en particular los de las membranas mitocondriales, lo que agota aún más el ATP. El bloqueo de los canales L deja los canales T desbloqueados. Y los productos de descomposición de la fosfolipasa ayudan a liberar grandes cantidades de iones de calcio que se han unido al retículo endoplásmico.
Los derivados de dihidropiridina (DHP), como la nimodipina, bloquean los canales de calcio de tipo L. Pero el principal beneficio de los DHP en la isquemia parece ser la dilatación de las arteriolas más que el bloqueo de los canales de calcio de las neuronas. El pretratamiento de perros con nimodipino antes de diez minutos de isquemia condujo a una tasa de recuperación normal del 80 %, en comparación con una tasa de mortalidad del 86 % en los controles no tratados. El tratamiento 2 minutos después de la isquemia tuvo un efecto insignificante. [FARMACOLOGÍA DE LA ISQUEMIA CEREBRAL, Joseph Krieglstein, Editor, p.65-73 (1988)].
Los estudios en animales han demostrado el beneficio de antioxidantes como la vitamina E [BRAIN RESEARCH 510: 335-338 (1990)], melatonina y nifedipina [JOURNAL OF PINEAL RESEARCH 33: 87-94 (2002)], resveratrol [BRAIN RESEARCH 958: 439- 447 (2002)], deprenyl [JOURNAL OF NEURAL TRANSMISSION 107:779-786 (2000)] y PBN [ ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE.UU.); 92(11):5057-5061 (1995) ]. Los anestésicos locales tienen el potencial de reducir el daño isquémico al tejido cerebral al bloquear el sodio (Na +) — reduciendo la actividad eléctrica y la tasa metabólica más allá de lo que se puede lograr con los barbitúricos [PHARMACOLÓGICA REVISIONES 48(1):21-67 (1996)]. Pero todos estos agentes no han logrado pasar los ensayos clínicos ni ser aceptados como agentes terapéuticos. Actualmente, los únicos fármacos aceptados que se utilizan para el tratamiento del ictus son los trombolíticos, los anticoagulantes y los fármacos antiplaquetarios.
La degradación de la fibrina en los coágulos sanguíneos por la proteasa (enzima digestiva de proteínas) plasmina requiere la conversión de plasminógeno en plasmina por medio del activador tisular del plasminógeno ( tPA ).). La administración de tPA es útil para romper los coágulos de sangre, pero solo cuando se administra dentro de las 3 horas posteriores al inicio del accidente cerebrovascular. Cuando se administra dentro de los 90 minutos posteriores al accidente cerebrovascular, el tPA puede más que duplicar la supervivencia a los 3 meses de los pacientes con accidente cerebrovascular [NEUROLOGY 55(11):1649-1655 (2000)]. Debido al riesgo de daño por reperfusión o hemorragia, los trombolíticos también se evitan en pacientes con hipertensión severa, de edad avanzada o con evidencia de edema cerebral. El manitol se ha utilizado para reducir el edema cerebral, pero no en el accidente cerebrovascular [PROGRESS IN CARDIOVASCULAR DISEASES 42(3):209-216 (1999)].
Debido a que la plasmina producida por el tPA es una proteasa no específica, no solo disuelve los coágulos, sino que contribuye a la degradación vascular y a la apertura de la barrera hematoencefálica por las metaloproteinasas de matriz ( MMP ) [ STROKE; Pfefferkorn,T; 34(8):2025-2030 (2003) ], y por lo tanto puede empeorar el daño por lesión por reperfusión si se administra en reperfusión retardada. En general, se considera que el tratamiento con tPA hace más daño que bien si se administra más de 3 horas después de un accidente cerebrovascular [ACV ; Clark, WM; 31(4):811-816 (2000) ] y en cualquier momento si el accidente cerebrovascular afecta una gran área del cerebro [ JOURNAL OF NEUROLOGY, NEUROSURGERY, AND PSYCHIATRY; 65(1):1-9 (1998) ]. Tetraciclinas, particularmente minociclina, se ha demostrado que no solo reducen la inflamación asociada a la isquemia [ ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE. UU.); Yrjanheikki, J; 96(23):13496-13500 (1999) ], sino para inhibir las MMP [ BMC NEUROSCIENCE; Machado,LS; 7:56 (2006) ]. La inhibición de la citoquina inflamatoria IL-1β puede reducir significativamente el volumen del infarto cerebral [ JOURNAL OF CEREBRAL BLOOD FLOW & METABOLISM; 65(1):1-9 (1998) ].
En muchos casos, los accidentes cerebrovasculares pueden resolverse espontáneamente en cuestión de días, pero la causa de esta "recanalización" es incierta [ ACV; Molina, CA; 32(5):1079-1084 (2001) y ARCHIVOS DE NEUROLOGÍA; Kassem-Moussa,H; 59(12):1870-1873 (2002)].
Antes del tPA, la estreptoquinasa y la uroquinasa eran los trombolíticos más eficaces. El anticoagulante heparina se administra en el hospital y la warfarina se usa para el mantenimiento a largo plazo. Es una práctica común que las heparinas de bajo peso molecular se administren en hospitales como profilaxis contra la trombosis venosa profunda, como en el caso de los pacientes con cáncer postrados en cama de forma crónica [ JOURNAL OF ONCOLOGY PHARMACY PRACTICE; Nishioka,J; 13(2):85-97 (2007) ]. La aspirina se puede utilizar como agente antiplaquetario. Estas terapias no se pueden usar para el accidente cerebrovascular hemorrágico porque empeoran esa condición.
Para propósitos de criónica, la estreptoquinasa es el trombolítico de elección porque una dosis de tPA cuesta miles de dólares, mientras que la estreptoquinasa cuesta unos pocos cientos de dólares. La estetoquinasa se puede pedir a Sigma-Aldrich (Número CAS 9002-01-1) oa otros proveedores de medicamentos.
V. HIBERNACIÓN Y ESTIVACIÓN
Los animales que hibernan o estivan pueden evitar o reducir significativamente el daño isquémico al reducir su metabolismo. Los mecanismos de protección utilizados por los estivadores y los hibernadores pueden proporcionar información sobre la naturaleza del daño isquémico y posiblemente sobre los medios para prevenir dicho daño. La estivación es un estado de hipometabolismo aeróbico que protege a los animales de condiciones secas (a menudo calientes). Las alteraciones en el metabolismo asociadas con la estivación incluyen retención de agua, síntesis de proteínas muy reducida, bombeo de iones reducido, acumulación de urea y dependencia de la oxidación de lípidos (en lugar de la glucólisis) para obtener energía, asociado con una actividad de oxidasa de citocromo c muy reducida en las mitocondrias [BIOQUÍMICA Y FISIOLOGÍA COMPARATIVAS]. PARTE A; Piso, KB; 133:733-754 (2002)]. cardiolipina es un fosfolípido que se sintetiza exclusivamente en la mitocondria y se requiere para la máxima actividad de transporte de electrones. El contenido de cardiolipina de las mitocondrias de los caracoles en estivación se reduce en un 80 %, asociado con una reducción similar de la actividad de la citocromo c oxidasa [ AMERICAN JOURNAL OF PHYSIOLOGY; Estuardo,JA; 275(6Pt2):R1977-R1982 (1998) ]. La acumulación de amoníaco tóxico se evita mediante el aumento de la síntesis de urea, a pesar de que requiere energía [ JOURNAL OF EXPERIMENTAL BIOLOGY; masticar, SF; 207:777-786 (2004) ].
En las ardillas árticas en hibernación, el recuento de leucocitos cae hasta 100 veces, lo que protege contra el fenómeno de adhesión de leucocitos "sin reflujo" asociado con el flujo sanguíneo interrumpido o muy reducido [BIOLOGÍA Y MEDICINA DE RADICALES LIBRES; Dibujó, KL; 31(5):563-573 (2001)]. La frecuencia cardíaca puede reducirse 100 veces, la tasa metabólica puede reducirse a menos del 5 % de lo normal y la temperatura corporal puede descender hasta cerca de 0 °C en los mamíferos pequeños que hibernan. (En los mamíferos que no hibernan, las temperaturas de 10ºC a 20ºC detendrán el corazón.) Se reduce la salida pasiva de K + y la entrada pasiva de Na + . Se potencia el secuestro de Ca 2+ . La dependencia de la hidrólisis de lípidos como fuente principal de energía da como resultado cuerpos cetónicos que pueden proteger al cerebro contra el daño por hipoxia.REVISIONES FISIOLÓGICAS; Carey,HV; 83:1153-1181 (2003) ]. Los cambios en la expresión de la proteína del factor de transcripción Factor inducible por hipoxia ( HIF-1 ) pueden inducir la expresión de genes reguladores de la hibernación [BIOCHEMICA BIOPHYSICA ACT; Morín, P; 1729(1):32-40 (2005)].
VI. SOLUCIÓN DE TRASPLANTE DE ÓRGANOS
La isquemia fría , como la que experimentan algunos hibernadores y los órganos trasplantables que se conservan a bajas temperaturas, tiene características únicas que la distinguen de la isquemia caliente. A diferencia de la isquemia fría, la isquemia caliente inhibe la óxido nítrico sintasa y da como resultado la producción de vasoconstrictores eicosanoides durante la reperfusión [PROCEDIMIENTOS DE TRASPLANTE; Hansen, Tennessee; 32:15-18 (2000)]. Aunque la temperatura fría puede reducir la isquemia, puede introducir nuevas formas de daño, como la lesión por frío . A diferencia de la isquemia caliente, la isquemia fría también se asocia con un aumento en el hierro quelable que abre el poro de transición de permeabilidad mitocondrial ( MPTP )., lo que generalmente conduce a la apoptosis o (más a menudo) a la necrosis. Este fenómeno se ha demostrado en ausencia de un aumento de superóxido o peróxido de hidrógeno para las células endoteliales del hígado, en particular, pero también para otros tejidos [JOURNAL OF HEPATOLOGY; Rauen,U; 40(4):607-615 (2004)].
Algunos agentes neuroprotectores que no han superado los ensayos clínicos para el tratamiento de accidentes cerebrovasculares han demostrado tener un beneficio demostrable en la conservación de órganos para trasplantes. Las explicaciones de los beneficios de los ingredientes utilizados en la solución de preservación de órganos Viaspan® (desarrollada como UW Solution — University of Wisconsin) se pueden encontrar en el sitio web de Viaspan® o en [TRANSPLANTACIÓN; Belzer,FO; 45(4):673-676 (1988)].
El alopurinol inhibe la xantina oxidasa, bloqueando la conversión de xantina y oxígeno en superóxido y ácido úrico. El glutatión se utiliza como antioxidante con propiedades estabilizadoras de membrana. La hipotermia en realidad puede aumentar la permeabilidad de las células al glutatión [CRIOBIOLOGÍA; Vreugdenhil,PK; 28:143-149 (1991)]. La dexametasona también puede estabilizar las membranas, pero su beneficio real en Viaspan es dudoso. El magnesio parece contrarrestar algunos de los efectos del calcio intracelular y el ion sulfato resiste la inflamación celular porque es relativamente impermeable a las membranas celulares.
| adenosina | ATP, ADP y AMP |
|---|---|
![[ Adenosina ]](https://benbest.com/cryonics/adenosine.gif) | ![[ATP, ADP y AMP]](https://benbest.com/cryonics/ATP.gif) |
El ATP (trifosfato de adenosina) se degrada rápidamente a adenosina, inosina e hipoxantina, las cuales atraviesan fácilmente las membranas celulares y pueden perderse por difusión. Para contrarrestar la pérdida de ATP, se agrega adenosina (adenina conectada a la ribosa) para proporcionar más sustrato para la síntesis de ATP. La adenosina también reduce la adherencia de los neutrófilos al endotelio e inhibe la producción de especies reactivas de oxígeno por parte de los neutrófilos [AMERICAN JOURNAL OF PHYSIOLOGY 257(2 Pt 2):H1334-H1339 (1989)]. El fosfato de potasio monobásico también proporciona sustrato para la síntesis de ATP mientras se opone a la acidificación (de la glucólisis anaeróbica y la producción de ácido láctico) y la fuga de potasio. El hidróxido de potasio también mantiene un pH alto mientras se opone a la fuga de potasio.
HydroxyEthyl Starch (HES) se agrega a la solución UW para soporte oncótico, es decir, para prevenir el edema en el espacio intersticial al mantener más líquido en los vasos sanguíneos (un papel que normalmente desempeña la albúmina sanguínea). HES reduce la adhesión de leucocitos a los vasos sanguíneos durante la reperfusión [ STROKE; Kaplan,SS; 31(9):2218-2223 (2000) ]. Aunque HES es de mayor valor para la perfusión, se ha demostrado que es beneficioso para mejorar el almacenamiento en frío de los órganos [TRASPLANTE; Southard,JH; 49(2):251-257 (1990)]. Debido a que HES es difícil de obtener y puede causar alteraciones en la microcirculación, se ha utilizado polietilenglicol (PEG) como reemplazo de HES con buenos resultados [ THE JOURNAL OF PHARMACOLOGY AND EXPERIMENTAL THERAPEUTICS; Faure, J; 302(3):861-870 (2002)y REVISTA DE GASTROENTEROLOGÍA Y HEPATOLOGÍA; Franco-Gou,R; 22(7):1120-1126 (2007)].
El dextrano-40 (peso molecular 40 kilodaltons) inhibe la agregación celular y puede reemplazar al HES como un agente oncótico menos viscoso que se excreta fácilmente por los riñones.
HEPES es un tampón de iones de zwitter que es lo suficientemente grande (238 daltons) para proporcionar soporte osmótico extracelular. La constante de ionización del agua disminuye ( pK w aumenta) a medida que disminuye la temperatura, lo que significa que el pH aumentará con la disminución de la temperatura. El pK de los tampones de fosfato y bicarbonato no cambia mucho con la temperatura, pero el pK del tampón HEPES aumenta con la caída de la temperatura, compensando así el aumento de pK del agua. Por lo tanto, HEPES es un mejor amortiguador que el fosfato o el bicarbonato para mantener la estructura y función de la proteína (enzima) en hipotermia [CRIOBIOLOGÍA; Baicu, SC; 45(1):33-48 (2002)].
El lactobionato y la rafinosa son moléculas grandes que se agregan para el soporte osmótico y para prevenir la inflamación celular que resultaría de la reducción de la actividad de la bomba de sodio. El lactobionato es un fuerte quelante de los iones de calcio y hierro. El calcio puede empeorar el daño isquémico, pero una solución sin calcio aumentará la permeabilidad de la membrana al calcio, lo que empeorará los efectos de la exposición posterior al calcio (la "paradoja del calcio"). Solo se necesitan cantidades muy pequeñas de calcio para prevenir la paradoja del calcio [CIRCULACIÓN; Marbán,E; 80 (6 suplemento): IV17-22 (1989)].
La penicilina en solución UW puede prevenir el crecimiento bacteriano. La insulina puede aumentar la absorción de glucosa por las células, pero la glucosa se omite en la solución UW para reducir la acidosis celular (producción de ácido láctico por glucólisis).
Se ha informado que Viaspan® (solución UW) está contaminada con hierro y pierde glutatión antes de su uso [TRASPLANTE; Salahadeen, Alaska; 70(10):1424-1431 (2000)]. Viaspan no reduce la pérdida extrema de calcio mitocondrial y celular por causas desconocidas asociadas con la hipotermia [TRASPLANTE; Kim,J; 65(3):369-375 (1998)].
Se han propuesto varios aditivos nuevos para las soluciones de trasplante de órganos para prevenir la lesión isquémica por frío. La dopamina , por ejemplo, reduce la oxidación isquémica por frío [AMERICAN JOURNAL OF TRANSPLANTATION; Patio,B; 4:22-30 (2004)]. Pero el daño de los radicales libres asociado con la isquemia fría evidentemente se debe principalmente a una liberación hipotérmica de hierro. Por lo tanto, sería mucho más efectivo eliminar la fuente de radicales libres mediante el uso de un quelante de hierro [JOURNAL OF INVESTIGATIVE MEDICINE; Rauen,U; 52(5):299-309 (2004)]. La deferoxamina se ha utilizado para este fin, pero se ha demostrado que un nuevo derivado de tetraazaannulene (TAA-1) inhibe por completo la lesión inducida por el frío que resulta de la liberación de hierro quelable [BIOLOGÍA Y MEDICINA DE RADICALES LIBRES; Rauen,U; 37(9):1369-1383 (2004)].
La glicina reduce la lesión hipóxica al reducir los flujos de iones a través de la membrana plasmática de Na + y Ca 2+ [JOURNAL OF HEPATOLOGY; franco, A; 32:58-66 (2000)]. La capacidad de la glicina para afectar el flujo de Cl - no es relevante para este efecto protector. La glutamina inhibe la proteólisis y puede activar la proteína de choque térmico, mientras que la adición de otros aminoácidos puede tener un beneficio nutricional [TRASPLANTE DE HÍGADO; Bessems,M; 11(11):1379-1388 (2005)]. Los compuestos que liberan monóxido de carbono tienen un efecto vasodilatador protector y aumentan la respiración mitocondrial después de la isquemia fría y la reperfusión [KIDNEY INTERNATIONAL; Sanduka,A; 69(2):239-247 (2006)].
Aunque Viaspan® fue tratado como una solución de preservación hipotérmica universal durante casi una década, a mediados de la década de 1990, las soluciones de "tipo intracelular" con alto contenido de potasio, como Hypothermosol®, demostraron ser superiores para preservar corazones y pulmones, así como otras células y tejidos
(Para obtener más información sobre las soluciones de preservación de órganos, consulte Reemplazo y lavado de sangre y Reducción del daño isquémico por enfriamiento ).
VIII. DAÑO CEREBRAL POR ISQUEMIA/REPERFUSIÓN
La nanotecnología puede reparar el daño por congelamiento porque la estructura del cerebro permanece, aunque en forma codificada. A diferencia del daño por congelación, la isquemia caliente eventualmente conduce a la disolución del tejido cerebral en una sopa sin estructura.
Por otro lado, no se pueden sostener las afirmaciones de que unas pocas horas de isquemia caliente significan una cierta pérdida de identidad personal. Incluso después de dos horas de isquemia caliente (sin reperfusión), las membranas lisosomales de las células cerebrales de gato permanecen intactas [VIRCHOWS ARCHIV B 25:207-220 (1977)]. Los cerebros de mono sometidos a una hora de isquemia caliente y protegidos de la lesión por reperfusión muestran una recuperación a corto plazo [JOURNAL OF CEREBRAL BLOOD FLOW AND METABOLISM 6(1):15-33 (1986)]. Cerebros de ratón post-mortem sometidos a 6 horas a temperatura ambiente y otras 18 horas a 4ºC muestran que la mitad de las neuronas están morfológicamente intactas [VIRCHOWS ARCHIV B 63:331-334 (1993)]. Se ha demostrado que las neuronas en tejido cerebral extraído de seres humanos post mortem durante 3 a 6 horas recuperan el metabolismo oxidativo y el transporte de axones después de un tratamiento in vitro adecuado [THE LANCET 351:499-500 (1998)].CARRERA; 26(4):636-643 (1995) ]. Se han observado resultados similares en humanos [ANNALS OF NEUROLOGY; 2:206-210 (1977)].
Las neuronas piramidales CA1 del hipocampo a menudo se consideran las más sensibles a la lesión isquémica de todas las neuronas. Después de 30 minutos de isquemia y posterior reperfusión, las neuronas CA1 mueren invariablemente después de 2 o 3 días, mientras que las neuronas estriatales supuestamente resistentes comienzan a morir después de varias horas [ANNALS OF NEUROLOGY 11:491-498 (1982)]. En cualquier caso, un paciente de criónica debe estar en una condición de baja temperatura mucho antes de ese momento.
La muerte celular por apoptosis ("suicidio celular") es un proceso controlado por el cual las células mueren de forma lenta y ordenada para ser eliminadas por los macrófagos. La necrosis , por el contrario, es más rápida y provoca la ruptura de la membrana celular, el derrame del contenido celular y la inflamación. La apoptosis requiere la transcripción del ADN, la síntesis de nuevas proteínas, un proceso que requiere muchas horas, si no días.
Se ha demostrado que la rapidez y forma de muerte celular es una función del grado de agotamiento de ATP. Las células de riñón de ratón en las que los niveles de ATP eran del 15% o menos de lo normal (menos que el control) murieron por necrosis durante un período de entre 2 y 4 horas. Las células con niveles de ATP del 25 % de lo normal permanecieron viables durante al menos 6 horas, pero todas experimentaron muerte apoptótica a las 48 horas [ AMERICAN JOURNAL OF PHYSIOLOGY; 274 (2 parte 2): F315-F327 (1998) ].
La apoptosis probablemente no sea un riesgo final para los pacientes con criónica que se desanimen sin daño isquémico pre-mortem y que reciban soporte cardiopulmonar y enfriamiento inmediatos. Así como la tecnología futura puede revertir la "muerte" en personas completas, la tecnología futura también debería poder revertir mucho de lo que pasa por la muerte irreversible de las células. Ciertamente deberíamos esperar reversibilidad desde las primeras etapas de la apoptosis. La muerte celular por necrosis debería ser mucho más preocupante que la apoptosis en criónica.
El efecto más dañino de la isquemia dentro de la primera o segunda hora es la capacidad del flujo sanguíneo cerebral [BRAIN RESEARCH 81:59-74 (1974)]. La acidosis láctica hace que las células endoteliales se hinchen [ACTA NEUROPATHOLOGIA 60:232-240 (1983)]. Los glóbulos se endurecen y aglutinan. Cuanto más larga sea la isquemia, peor será la lesión por reperfusión de los vasos sanguíneos debido a los radicales libres y la hemorragia, y mayor será la posibilidad de "falta de reflujo" (circulación impedida). Sin circulación no puede haber soporte cardiopulmonar ni perfusión de crioprotectores.
VIII. PREVENCIÓN DE LESIONES ISQUÉMICAS/REPERFUSIÓN EN CRYONICS
Mediante el uso de un cóctel de agentes Mike Darwin y el Dr. Steve Harris de Critical Care Research se extendió el período en que los perros pueden tolerar la isquemia caliente (a temperatura ambiente) a 17 minutos. Según los informes, un cóctel de tales agentes nunca podría pasar la aprobación de la FDA para la terapia de accidentes cerebrovasculares o el tratamiento de un paro cardíaco, por lo que no recibió un interés generalizado o aplicación en la medicina convencional. Los perros tienen una frecuencia cardíaca y una tasa metabólica más altas que los humanos. Se estima que la tolerancia isquémica para humanos es tan alta como 20 minutos [CRITICAL CARE MEDICINE 16(10):923-941 (1988)].
Sin embargo, en circunstancias ideales, un paciente de criónica experimenta poca isquemia a temperatura ambiente. Si se inicia inmediatamente el apoyo cardiopulmonar y el enfriamiento, se puede minimizar la isquemia. En circunstancias no ideales, la isquemia a temperatura ambiente suele durar considerablemente más de 17 minutos.
Se suele señalar que la tasa metabólica se reduce a la mitad por cada 10 ºC de descenso de la temperatura. Pero la reducción de la temperatura tiene un efecto protector que supera la reducción del metabolismo, debido a la reducción de la peroxidación lipídica. Experimentos en jerbos indican que una caída de temperatura de 37ºC a 31ºC casi triplica la cantidad de tiempo que las neuronas pueden tolerar la isquemia [CRITICAL CARE MEDICINE 31(1):255-260 (2003)]. Los perros enfriados a 20ºC pueden soportar 60 minutos de isquemia y pueden soportar 120 minutos de isquemia a 10ºC [CRITICAL CARE MEDICINE 31(5):1523-1531 (2003)]. Temperaturas inferiores a 15ºC reducen considerablemente el estrés oxidativo isquémico en ratones [RADICALES LIBRES & BIOLOGÍA Y MEDICINA; Khandoga,A; 35(8):901-909 (2003)].
Una reducción de la temperatura de 37ºC a 26ºC inhibió completamente la liberación de neurotransmisores inducida por potasio de astrocitos de rata [JOURNAL OF CEREBRAL BLOOD FLOW AND METABOLISM 15:409-416 (1995)]. Los marcados aumentos en los productos finales de óxido nítrico causados por la infusión de glutamato en ratas se eliminaron por completo al reducir la temperatura de 37 °C a 32 °C [JOURNAL OF NEUROTRAUMA 20(11):1179-1187 (2003)]. Las ratas reperfundidas después de un período isquémico de 15 minutos tenían más de 3 veces más radicales hidroxilo una hora más tarde que las ratas sujetas a isquemia, pero no reperfundidas. Pero las ratas reperfundidas a 30ºC en lugar de 36ºC tenían la mitad de radicales hidroxilo que las ratas reperfundidas a 36ºC [JOURNAL OF CEREBRAL BLOOD FLOW AND METABOLISM 16:100-106 (1996)]. Los efectos protectores de la hipotermia contra el daño isquémico son muy no lineales. Sin embargo,
Si un paciente de criónica recibe apoyo cardiopulmonar inmediato, la isquemia se puede reducir en gran medida, si no se elimina. El flujo sanguíneo cerebral fisiológico normal es de aproximadamente 50 ml por 100 gramos de tejido cerebral por minuto. Un buen soporte cardiopulmonar puede mantener el flujo sanguíneo cerebral no mucho más alto que 15 ml (y generalmente más bajo), pero solo con la ayuda de epinefrina [CIRCULATION 69(4):822-835 (1984)]. Esto está críticamente cerca de los 10 ml asociados con el comienzo del daño celular irreversible si dicho caudal se mantiene durante un período prolongado [JOURNAL OF NEUROSURGERY 77: 169-184 (1992)]. La compresión-descompresión activa y la compresión abdominal interpuesta pueden mejorar considerablemente la perfusión de la RCP [ CIRCULATION;100(21):2146-2152 (1999) ], al igual que los dispositivos mecánicos (ver más abajo).
Con un enfriamiento eficaz, el flujo proporcionado, incluso con una RCP moderadamente eficaz, puede ser adecuado para mantener la estructura cerebral. La ley de enfriamiento de Newton dicta que la caída de temperatura es más rápida tras la aplicación inicial de enfriamiento. Y hay una caída natural en la temperatura del cerebro asociada con la reducción del flujo sanguíneo. En estas circunstancias, el beneficio adicional de los agentes antiisquémicos puede no ser muy grande. (Para obtener más información sobre las velocidades de enfriamiento, consulte mi ensayo Parámetros físicos de enfriamiento en criónica ).
Estos hechos deberían brindar cierto consuelo a aquellos que sienten que no pueden permitirse el lujo de complementar el enfriamiento y el apoyo cardiopulmonar del rescate criónico con costosos cócteles antiisquémicos. No obstante, el pretratamiento del paciente con aspirina, vitamina E y otros antioxidantes es un medio económico de reducir la isquemia después de que el corazón se detiene. Tal pretratamiento puede dar mejores niveles de antioxidantes en los tejidos que infundirlos después de la desanimación. Debido a que la adenosina inhibe la liberación de glutamato , está contraindicado el consumo de café y té inmediatamente antes de la desanimación.
Los altos niveles de PARP-1 debido a los altos niveles de daño en el ADN pueden reducir el NAD+ necesario para la síntesis de ATP, lo que lleva al agotamiento de ATP y muerte celular por necrosis. O PARP-1 puede inducir la apoptosis mediante la estabilización de p53 y/o mediante la translocación del factor inductor de la apoptosis (AIF) al núcleo [EXPERIMENTAL HEMATOLOGY 31:446-454 (2003)]. Se han propuesto inhibidores de PARP-1 para proteger las neuronas de la excitotoxicidad y el daño isquémico.
El zinc (Zn 2+ ) contribuye significativamente a la muerte neuronal en la isquemia, pero el pretratamiento con EDTA 30 minutos antes del evento isquémico protege sólidamente a las neuronas [ THE JOURNAL OF NEUROSCIENCE; Calderón, A; 24(44):9903-9913 (2004) ]. El hierro y el cobre pueden contribuir significativamente al daño de los radicales libres en la isquemia, particularmente el hierro en la isquemia fría porque la isquemia fría libera hierro dentro de las células. Las células endoteliales se dañan significativamente más por la reperfusión después de la isquemia fría que después de la isquemia caliente [PROCEDIMIENTOS DE TRASPLANTE; de Groot,H; 39(2):481-484 (2007)]. El quelante de metales deferoxamina ha demostrado un beneficio significativo contra el daño isquémico catalizado por hierro, pero la deferoxamina no quela el cobre.REVISTA DE BIOLOGIA EXPERIMENTAL; Warner,DS; 207(18):3221-3231 (2004) ]. También se ha demostrado que otros quelantes de hierro son protectores [BIOLOGÍA Y MEDICINA DE RADICALES LIBRES; Rauen,U; 37(9):1369-1383 (2004)]. En la medida en que los glóbulos (leucocitos y eritrocitos) son fuentes de daño por reperfusión (citocinas, radicales libres y otras toxinas), la extracción de glóbulos antes de la isquemia fría (envío de un paciente criónico en hielo) puede reducir considerablemente el daño por reperfusión (asociado con perfusión crioprotectora) [ ACV; Sucio; 33(10):2492-2498 (2002) ].
Al menos dos estudios han demostrado que el deprenilpodría ser de valor en la reducción del daño isquémico en el cerebro. Un estudio [STROKE 26:1883-1887 (1995)] que involucró 14 días de deprenyl en ratas y 20 minutos de hipoxia/isquemia mostró una reducción del área de daño del 75% en el cerebro anterior y alrededor del 20% en la corteza. Para el hipocampo, el 30-38% del área resultó dañada en los controles, pero no se observaron daños en las ratas tratadas con depenil. Un estudio similar en jerbos [JOURNAL OF NEURAL TRANSMISSION 107:779-789 (2000)] mostró una reducción del daño en el área CA1 del hipocampo por deprenyl administrado más de una semana antes, inmediatamente después y más de una semana después de la isquemia debido a un vaso sanguíneo. oclusión. Los cultivos celulares expuestos a peroxinitrito han sido protegidos del daño apoptótico del ADN por deprenil [MECHANISMS OF AGEING AND DEVELOPMENT 111:189-200 (1999)].
La minociclina puede reducir la inflamación, el edema y el daño a la barrera hematoencefálica, especialmente cuando se usa el activador tisular del plasminógeno (tPA). La activación de MMP-9 por tPA puede contrarrestarse mediante el uso de hipotermia [ ACV; Horstmann,S; 34(9):2165-2170 (2003) ]. Aunque abrir la barrera hematoencefálica es valioso en el tratamiento del accidente cerebrovascular, puede o no serlo en la criónica en la medida en que abrir la barrera hematoencefálica puede ayudar a que los crioprotectores lleguen al cerebro. (Consulte las secciones anteriores sobre la lesión por reperfusión y la terapia del accidente cerebrovascular ).
La epinefrina se ha usado comúnmente para mantener la presión arterial y complementar la RCP al mantener la presión arterial, aunque también se puede usar vasopresina [CRITICAL CARE MEDICINE 30 (suplemento 4): S157-S161 (2002)]. La epinefrina, la heparina (anticoagulante), el tPA e incluso el apoyo cardiopulmonar podrían ser contraproducentes para un paciente criónico que sufre un accidente cerebrovascular hemorrágico [ STROKE; Steiner,T; 37(1):256-262 (2006) ].
En los hospitales, la epinefrina suele ser estándar para ACLS (soporte vital cardíaco avanzado). ACLS utiliza invariablemente la RCP manual, a pesar de la mejor entrega de sangre de los dispositivos mecánicos. Los dispositivos mecánicos son superiores a la RCP manual porque (1) la RCP manual se vuelve rápidamente menos eficiente porque es mucho más agotadora y (2) la RCP manual no puede administrar tanto volumen de sangre en el mejor de los casos porque un dispositivo mecánico puede administrar una alta velocidad más rápida. compresión de onda cuadrada de impulso .
El pronunciamiento de la muerte puede ocurrir poco después de que el corazón se detenga. En una situación de no resucitar (DNR), la aplicación rápida de RCP podría hacer que la persona legalmente muerta recupere el conocimiento. Es poco probable que el corazón pueda reiniciarse en un adulto, especialmente si la isquemia tiene niveles elevados de potasio extracelular y plasmático. El corazón rara vez se reinicia sin desfibrilación electrónica, excepto en niños pequeños.
La recuperación de la conciencia por parte de un paciente de criónica proporcionaría garantías de la eficacia del soporte cardiopulmonar, pero sería traumático para todos los involucrados y un desastre "político". Los barbitúricos serían un medio efectivo para mantener la inconsciencia, pero como narcótico, su uso puede ser un riesgo tanto político como legal. Afortunadamente, el propofol no es una sustancia controlada y puede mantener inconsciente al paciente. Afortunadamente, también se ha demostrado que el propofol inhibe la apoptosis de las células neurales que puede ocurrir como consecuencia de una lesión por isquemia/reperfusión [ THE JOURNAL OF NEUROSCIENCE; poliéster, BM; 23(7):2735-2743 (2003) ]. Propofol inhibe la apertura del Poro de Transición de la Permeabilidad Mitocondrial ( MPTP ) [INVESTIGACIÓN CARDIOVASCULAR; Javadov,SA; 45(2):360-369 (2000)]. Si un director de funeraria, un profesional médico u otra persona puede administrar heparina, también debería poder administrar epinefrina, propofol, un trombolítico, antioxidantes y otros agentes para combatir la acidosis.
(Para obtener detalles sobre cambios post mórtem más avanzados, consulte Cambios post mórtem o Química de la descomposición ).
(Para una revisión más detallada de los medicamentos criónicos, consulte Direcciones futuras en la farmacoterapia combinada de criopreservación humana ).
IX. PRETRATAMIENTO PARA PACIENTES CRYONICS
Para el paciente criónico terminal cabe preguntarse, ¿por qué esperar hasta después de la declaración de muerte legal antes de utilizar antioxidantes u otros agentes que puedan reducir el daño isquémico? Se pueden lograr niveles más altos en sangre y tejidos de algunos antioxidantes si se administran en los días o semanas antes de la muerte legal que si se administran después del evento. Para los antioxidantes que son legales y seguros, un protocolo de pretratamiento tiene mucho sentido, aunque ha habido pocos estudios controlados sobre dicho pretratamiento por parte de investigadores de criónica o cualquier otra persona. Los experimentos relevantes en la literatura generalmente implican un pretratamiento dentro de una hora antes de la inducción de la isquemia.
Se ha demostrado que la inyección intravenosa de la forma alfa-tocoferol de vitamina E (20 mg/kg o 9 mg/libra) 30 minutos antes de la isquemia reduce significativamente la peroxidación lipídica y el daño neurológico [STROKE 14(6):977-982 (1983) )]. Un mejor experimento habría incluido tanto el alfa-tocoferol como el gamma-tocoferol porque el gamma-tocoferol elimina el peroxinitrito mientras que el alfa-tocoferol no [ ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE. UU.); 94(7):3217-3222 (1997) ].
El pretratamiento con vitamina E para pacientes con criónica tiene la ventaja adicional de reducir la coagulación de la sangre y no presenta el riesgo de sangrado gástrico asociado con la aspirina. Muchos aceites de pescado (especialmente el aceite de salmón) brindan el mismo beneficio, además de reducir el riesgo de paro cardíaco [MOLECULAR AND CELLULAR BIOCHEMISTRY 116(1-2):19-25 (1992)]. La reducción de la coagulación en un paciente de criónica es un gran beneficio, y es motivo para la inyección de heparina después de la muerte legal. Sin embargo, para los pacientes que se someten a cirugía, la vitamina E y los aceites de pescado pueden estar prohibidos porque se desea la coagulación.
A diferencia de la vitamina E, la melatonina actúa como antioxidante a través de la donación endógena de electrones, que no tiene el mismo potencial de efecto secundario prooxidante [JOURNAL OF PINEAL RESEARCH 32:135-142 (2002)]. La capacidad de la melatonina para eliminar los radicales hidroxilo es tres órdenes de magnitud mayor que la de la vitamina E [ JOURNAL OF BIOLOGICAL CHEMISTRY; 274(31):21937-21942 (1999)]. El pretratamiento de jerbos con melatonina (10 mg/kg o 4,5 mg/libra) 30 minutos antes de la reperfusión redujo significativamente la lesión cerebral isquémica [JOURNAL OF PINEAL RESEARCH 29:217-227 (2000)]. Se lograron efectos similares con ratas, pero 5 mg/kg mostraron un mayor beneficio que una dosis más alta o más baja [JOURNAL OF PINEAL RESEARCH 34:110-118 (2003)]. La melatonina también puede proteger contra la lesión por isquemia-reperfusión al inhibir la producción de óxido nítrico inducible, al menos parcialmente mediante la inhibición de la activación del factor de transcripción proinflamatorio NF-κB y el bloqueo de la unión de NF-κB al ADN [ THE FASEB JOURNAL; Gilad,E; 12(9):685-693 (1998) ]. Se ha demostrado que el óxido nítrico exacerba la apoptosis debido a la liberación de calcio de la mitocondria.piscina y activación del Poro de Transición de la Permeabilidad Mitocondrial ( MPTP ) [ EL REVISTA FASEB; Cuerno, TFW; 16(12):1611-1622 (2002) ].
El ácido lipoico es beneficioso para reducir el daño por isquemia-reperfusión por acción directa, así como por la protección del glutatión y la inhibición de la xantina oxidasa [BIOLOGÍA Y MEDICINA DE RADICALES LIBRES; Packer, L.; 19(2):227-250 (1995)]. La protección contra el daño del peroxinitrito por el ácido lipoico depende en gran medida de la molécula objetivo (algunas moléculas están más protegidas que otras) [ JOURNAL OF BIOLOGICAL CHEMISTRY; Rezk, BM; 279(11):9693-9697 (2004) ]. La protección de las neuronas de la excitotoxicidad del glutamato es igualmente efectiva por la forma R y la forma S [BIOLOGÍA Y MEDICINA DE RADICALES LIBRES; Tirash,O; 26 (11/12): 1415-1426 (1999)].
Se ha demostrado que la coenzima Q 10 protege las células endoteliales de rata de la lesión por isquemia-reperfusión [CIRUGÍA; Yokoyama,H; 120(2):189-196 (1996)]. Los pacientes humanos con paro cardíaco admitidos en un hospital dentro de las 6 horas posteriores al paro cardíaco que recibieron una dosis de carga de 250 mg de CoQ 10 mostraron una supervivencia del 68 % en comparación con el 30 % de los controles. De los supervivientes, el 36 % del grupo CoQ 10 tuvo un buen resultado neurológico, en contraste con el 20 % de los controles [ CIRCULATION; Damián,MS; 110(19):3011-3016 (2004) ].
El pretratamiento de jerbos con deprenil (0,25 mg/kg o 0,11 mg/libra) dos semanas antes de la isquemia redujo el daño a las neuronas en el hipocampo [JOURNAL OF NEURAL TRANSMISSION 107:779-786 (2000)]. La infusión de N-acetilcisteína (15 gramos) en pacientes humanos con infarto de miocardio durante un período de 24 horas redujo significativamente el daño isquémico [ CIRCULATION 92(10):2855-2862 (1995) ].
La curcumina fitoquímica (que le da al curry su color amarillo) es un poderoso antioxidante varias veces más potente que la vitamina E [ THE JOURNAL OF NEUROSCIENCE 21(21):8370-8377 (2001) ]. A diferencia del alfa-tocoferol , la curcumina puede eliminar el peroxinitrito e inhibir la óxido nítrico sintetasa inducible [ CARCINOGÉNESIS; Rao,CV; 20(4):641-644 (1999) ], que tiene el potencial de reducir significativamente el daño por peroxinitrito durante la reperfusión.
La vitamina C no debe utilizarse para el pretratamiento de isquemia-reperfusión. La vitamina C es un antioxidante en ausencia de iones metálicos, pero en presencia de iones metálicos, que se liberan en grandes cantidades del tejido cerebral isquémico, la vitamina C se convierte en un poderoso prooxidante . (Para más información, consulte Moléculas antioxidantes ).
En resumen, un régimen de pretratamiento para un paciente con criónica terminal que pesa 100 kilogramos (220 libras) debe contener al menos alrededor de 600 mg por día de ácido alfa lipoico (1000 mg por día si es racémico en lugar de la forma R), 500 mg por día de CoEnzima Q 10, y 2000 UI (mg) por día de tocoferol mixto (cantidades iguales de alfa y gamma). Si se puede predecir el momento de la desanimación (muerte) (como con la retirada del soporte vital), se deben administrar 50 mg de melatonina 30 minutos antes de la retirada del soporte vital. La melatonina se metaboliza rápidamente (no se almacena en los tejidos), por lo que su valor para el pretratamiento prolongado podría ser discutible. Sin embargo, a favor de su uso para el pretratamiento está la lesión isquémica que sufren los pacientes terminales durante el proceso de muerte (aunque si los antioxidantes retrasan la muerte, el daño neto puede ser el mismo al final). También se recomendaría el uso de curcumina, aunque no hay una dosis sugerida.
X. CONCLUSIONES
Cuando el soporte cardiopulmonar y el enfriamiento se inician poco después de la desanimación, el uso de agentes antiisquémicos probablemente tenga un beneficio marginal. Sin embargo, el pretratamiento con altos niveles de antioxidantes debería ser fácil de hacer y ser beneficioso. Los niveles de dosificación apropiados son conjeturas. Pero sí parece que para los antioxidantes que tienen pocos efectos secundarios, un paciente con criónica terminal se beneficiaría al tomar dosis varias veces superiores a las que se considerarían normales para una persona que toma suplementos.
Las condiciones para la crioconservación nunca son óptimas y el llamado tratamiento deficiente no debe descartarse como "no vale la pena el esfuerzo". La identidad personal bien puede sobrevivir a un daño isquémico considerable. Menos daño es mejor, pero no a un costo ilimitado. Los cálculos de costo/beneficio son difíciles de hacer cuando el beneficio es tan difícil de cuantificar. La máxima prioridad debe ser garantizar que la muerte no golpee en momentos y lugares que dejen a uno completamente desprevenido para comenzar el enfriamiento oportuno y el soporte cardiopulmonar.
 diciembre 16, 2022
diciembre 16, 2022
 Posted in:
Posted in: 
