viernes, 16 de diciembre de 2022
Vitrificación en Criónica
 diciembre 16, 2022
diciembre 16, 2022
CONTENIDOS: ENLACES A SECCIONES
- VITRIFICACIÓN EN LA NATURALEZA
- LA QUÍMICA FÍSICA DE LA VITRIFICACIÓN
- BLOQUEADORES DE HIELO (INCLUYENDO PROTEÍNAS ANTICONGELANTES)
- CRIOPRESERVACIÓN DE CÉLULAS, TEJIDOS Y ÓRGANOS
- CRIOCONSERVACIÓN DE ÓRGANOS Y PACIENTES CRYONICS UTILIZANDO GLICEROL
- CRIOCONSERVACIÓN CON AZÚCARES
- VITRIFICACIÓN CON CRIOPROTECTORES SIN GLICEROL
- EL PROBLEMA DE LA DESVITRIFICACIÓN
- FRACTURA DE SUSTANCIAS VITRIFICADAS
I. VITRIFICACIÓN EN LA NATURALEZA
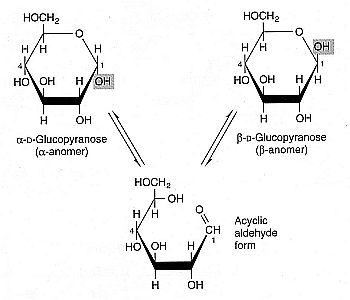
Aunque la mayoría de los organismos vivos están compuestos de grandes cantidades de agua, no es inevitable que la congelación de estos organismos provoque la formación de hielo. Entre los anfibios e insectos que pueden tolerar la congelación, existe una amplia variación en la cantidad de congelación que pueden tolerar.
Las especies de ranas pueden pasar días o semanas "con hasta el 65 por ciento del agua corporal total en forma de hielo". Algunos anfibios logran su protección gracias al glicerol que fabrica su hígado. El glicerol es "anticongelante", reduce la formación de hielo y baja el punto de congelación. El glicerol (glicerina), como el etilenglicol (anticongelante de automóviles) es un crioprotector . La glucosa del azúcar también es un crioprotector, y las ranas árticas tienen una forma especial de insulina que acelera la liberación y absorción de glucosa en las células a medida que las temperaturas se acercan al punto de congelación. Un crioprotector puede hacer que el agua se endurezca como el vidrio , sin formación de cristales, un proceso llamado vitrificación . El daño por congelamiento a las células se debe a la formación de cristales de hielo.
Los insectos utilizan con mayor frecuencia azúcares como crioprotectores. También pueden abstenerse de comer (no es una dificultad tan grande porque su metabolismo se ralentiza a baja temperatura) y utilizar cubiertas cerosas resistentes para mantener las sustancias nucleantes fuera de su cuerpo cuando baja la temperatura. Los escarabajos árticos adultos ( Pterostichus brevicornis ) normalmente soportan temperaturas inferiores a -35ºC. Estos escarabajos han sido congelados en laboratorio a −87ºC durante 5 horas sin lesión aparente, es decir, demostraron "actividad dirigida y coordinada, como caminar, alimentarse y respuesta de evitación, y ninguna parálisis o comportamiento errático..." [SCIENCE 166:106-7 (1-OCT-69)]. (Una réplica de este experimento sería valiosa para confirmar o cuestionar los resultados). Esto parecería indicar que el tejido neurológico puede, en principio, recuperarse de manera funcional de la vitrificación. El glicerol, azúcares y otros crioprotectores que se producen naturalmente en estos organismos, no se encuentran en niveles que expliquen adecuadamente (con los conocimientos actuales de criobiología) la notable tolerancia a la congelación.
II. LA QUÍMICA FÍSICA DE LA VITRIFICACIÓN
El agua no es muy viscosa, por lo tanto, solo puede vitrificarse mediante una "congelación instantánea" extremadamente rápida de una pequeña muestra de aproximadamente 3 millones de ºC por segundo a −135 ºC. Bajo un enfriamiento tan rápido, las moléculas de agua no tienen tiempo para organizarse en una estructura de red cristalina. La viscosidad aumenta muy poco cuando el agua se enfría, pero a la temperatura de congelación se produce una transición de fase repentina a un cristal de hielo. La sílice fundida (dióxido de silicio, SiO 2 , vidrio líquido), por el contrario, es muy viscosa. Esta viscosidad es el resultado de la tendencia de la sílice a formar redes amorfas de polímeros en lugar de organizarse en una red cristalina ordenada.
El cuarzo (cristal de roca) y la arena son ejemplos de SiO 2 como cristal puro. SiO 2 que se ha hecho para existir en forma no cristalina se llama sílice vítrea ( sílice fundida ). Se pueden agregar óxidos para prevenir la cristalización y promover la vitrificación. Aproximadamente el 90 % de todo el vidrio fabricado (llamado vidrio de sosa y cal ) contiene aproximadamente un 12 % de sosa (Na 2 O o Na 2 CO 3 ) y cal (CaO) agregados al SiO 2 . La soda es análoga a los crioprotectores en la prevención de la cristalización (se agrega cal para evitar que el vidrio se disuelva en agua).![[GRÁFICO DE VARIACIÓN DE T<SUB>g</SUB> CON LA TASA DE ENFRIAMIENTO]](https://benbest.com/cryonics/tg.jpg)
Al enfriar la sílice muy lentamente, es posible formar cristales de roca, que tienen una densidad muy alta y un volumen bajo. Al enfriarse más rápido, la resistencia a la cristalización debido a la viscosidad y la ausencia de nucleadores hace que la sílice pase por debajo de su temperatura de congelación ( sobreenfriamiento ) y se vitrifique a cierta temperatura de transición vítrea ( Tg ). La viscosidad aumenta rápidamente hasta la solidificación cerca de Tg , pero en un rango de temperatura pequeño en lugar de a una temperatura precisa (en contraste con la cristalización o la fusión, que ocurre a una temperatura precisa). El cambio que ocurre en T g es simplemente un aumento rápido de la viscosidad, no un cambio de estado. La viscosidad se vuelve muy alta cerca de Tg cuando se enfría desde arriba, lo que significa que Tg se caracteriza mejor como una "transición de caucho/vidrio" que una "transición de líquido/vidrio". Además, T g es función de la velocidad de enfriamiento. Una velocidad de enfriamiento más rápida da como resultado una T g a una temperatura más alta, lo que conduce a un sólido que tiene un volumen alto (densidad más baja), es más amorfo y menos viscoso. Una velocidad de enfriamiento más lenta da como resultado una T g a una temperatura más baja, lo que conduce a un sólido que tiene un volumen bajo (densidad más alta), es menos amorfo y es más viscoso. En la práctica, Tgocurre dentro de un rango de temperatura estrecho porque cambiar la velocidad de enfriamiento en un orden de magnitud (es decir, por un factor de diez) solo cambia la T g en 3−5ºC.
Pero el volumen continúa disminuyendo y la viscosidad continúa aumentando por debajo de Tg . El cambio en Tg es cuantitativo, no cualitativo (en contraste con la cristalización). Debido a que el enfriamiento se produce desde el exterior hacia el interior, el enfriamiento demasiado rápido genera estrés cuando el núcleo más cálido necesita contraerse más que la superficie más fría. Esta es la razón por la cual el enfriamiento lento reduce el agrietamiento. A T g hay un aumento repentino en la viscosidad y la capacidad calorífica (generalmente muchos órdenes de magnitud), pero no hay una disminución repentina comparable en el volumen. De hecho, T g se caracteriza como un rango de temperatura donde la tasa de disminución del volumen disminuye, aunque el volumen continúa disminuyendo (y la viscosidad continúa aumentando) linealmente por debajo de T g. T g podría ser una temperatura crítica para el agrietamiento debido a que el aumento repentino de la viscosidad probablemente afectaría la conducción de calor y la tensión. [Para obtener más información sobre la Tg , el estrés y las velocidades de enfriamiento, consulte mis ensayos Parámetros físicos de enfriamiento en criónica y Lecciones para criónica de metalurgia y cerámica ].
El azúcar, como la sílice, puede formar un cristal (caramelo de roca) o un vaso (algodón de azúcar) dependiendo de la velocidad de enfriamiento. Al igual que el vidrio fundido, el azúcar líquido es muy viscoso y propenso a la formación de polímeros amorfos. En la sílice, los enlaces de polimerización tienden a ser de tipo iónico covalente "mixto", mientras que para el azúcar, la polimerización es asistida por fuerzas más débiles (van der Waals o enlaces de hidrógeno). En ningún caso estos enlaces tienen las longitudes de enlace y los ángulos de enlace definidos de los enlaces covalentes. El glicerol/agua en el cuerpo humano se parece más al azúcar que a la sílice. Pero la situación se complica por la presencia de muchas sales, proteínas, grasas, etc.
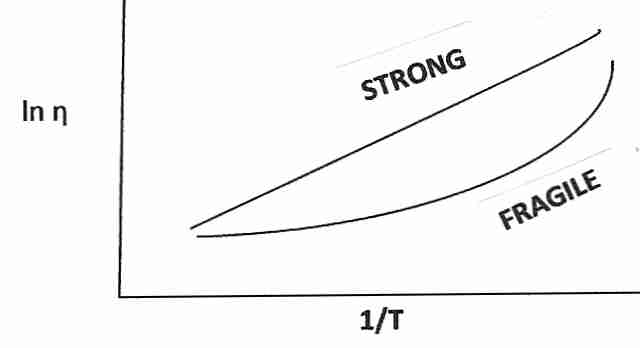 |
Los líquidos vitrificantes se han clasificado como "fuertes" o "frágiles". El término frágil es confuso porque no se refiere a la tendencia a romperse bajo tensión mecánica, sino a un aumento muy rápido de la viscosidad a medida que la temperatura se acerca a T g desde arriba. Las sustancias que se denominan frágiles tienden a tener más tipos de enlaces iónicos (o enlaces de hidrógeno), mientras que las sustancias que son fuertes (y muestran una modesta disminución de la viscosidad por encima de Tg ) tienen más enlaces covalentes. La "fuerza de agarre" cambia más radicalmente para el enlace iónico cerca de Tg . Los enlaces covalentes son más fuertes.(menos frágiles), y los grupos de moléculas que se mantienen unidas por enlaces covalentes son menos susceptibles a los cambios de fase molecular justo por encima de la Tg . Los crioprotectores de tipo glicerol (que se unen principalmente por enlaces de hidrógeno) son más "frágiles" que la sílice vítrea (que tiene coherencia covalente), pero son menos "frágiles" que las sustancias iónicas.
(Para obtener más información sobre el tema de la fragilidad, la viscosidad y la movilidad molecular, consulte Viscosidad y transición vítrea ).
Si el enfriamiento rápido provoca la vitrificación, parece plausible que la aplicación rápida de presión pueda hacer lo mismo, por encima de la T g para el enfriamiento rápido. Debido a que Tg es una función de la tasa de enfriamiento, no hay razón por la que no pueda ser también una función de la tasa de aplicación de presión, o alguna combinación de las dos (más el crioprotector). Se sabe que la presión distorsiona la red de hielo I de su orientación tetraédrica ideal, y esto podría ser importante para prevenir la nucleación.
|
El agua se puede vitrificar si se enfría a una velocidad de millones de grados centígrados por segundo. El agua también puede vitrificarse si se mezcla con sales o crioprotectores. Las soluciones salinas tienen su Tg más alta en su concentración eutéctica , pero esta sería demasiado concentrada para aplicaciones criobiológicas. Las soluciones salinas que tienen cationes con un alto estado de oxidación (p. ej., cationes trivalentes) y aniones más básicos (p. ej., citrato) son mejores formadores de vidrio (tienen una T g más alta ) que las soluciones salinas que no lo tienen. Los nitratos vitrifican mejor que los cloruros, y el magnesio (Mg 2+ ) vitrifican mejor que las sales de zinc (Zn 2+ ) [REVISTA DE FÍSICA QUÍMICA; Ángell, CA; 52(1):1058-1068 (1970)].
En la práctica, la vitrificación puede ser asistida por sustancias distintas de los agentes crioprotectores. Las soluciones portadoras pueden reducir la cantidad de crioprotector necesario para vitrificar. La solución portadora descrita en CRYOBIOLOGY 27(5):492-510 (1990) es una mezcla de sales, dextrosa y glutatión, y se basa en la llamada solución RPS-2 utilizada para almacenar riñones de conejo. Una solución portadora sustituirá al agua, pero solo en un rango de 2 a 5 %. El efecto de la solución portadora es en gran medida coligativo, es decir, las moléculas se interponen en el camino de las moléculas de agua que, de otro modo, podrían formar hielo. Una buena solución portadora no será tóxica y, al reducir la cantidad de crioprotector necesaria para vitrificar, se reducirá la toxicidad del crioprotector. [Para obtener más información sobre las soluciones de transporte, consulte mi ensayo Protocolo de perfusión y difusión en criónica .]![[ Tg y concentración de azúcar ]](https://benbest.com/cryonics/Sugar_Tg.jpg)
Cuando se produce la congelación en mezclas acuosas de solutos no cristalinos (como el helado), el soluto concentrado por congelación no congelado puede mostrar una temperatura de transición T g ' que tiene una firma térmica más prominente que T g . Tg ' es la Tg de la porción descongelada de una muestra que contiene hielo . Para el helado, T g ' es de aproximadamente −32ºC y el agua descongelada ( W g ' ) es de aproximadamente 35% en peso [ QUÍMICA DE LOS ALIMENTOS; Owen Fennema; 3ra Edición; Tabla 11; página 76 ]. ( W g es el contenido de agua de la muestra en Tg , mientras que W g ' es el contenido de agua no congelada en T g ' , que se ha denominado agua ligada , como si ese término pudiera aplicarse al contenido de agua de cualquier muestra vitrificada). Para solutos de bajo peso molecular, Tg ' (y Tg ) normalmente aumenta con el peso molecular. Los biopolímeros (almidón, gluten, colágeno, albúminas, etc.) de alto peso molecular suelen tener una T g ' cercana a los −10ºC.
Las soluciones acuosas de crioprotectores pueden congelarse y tener una porción no congelada que se solidifica a una temperatura T g ' que es considerablemente más alta que T g [ JOURNAL OF FOOD SCIENCE; Freno,NC; 64(1):10-15 (1999) ]. La temperatura de transición vítrea de la porción máximamente concentrada por congelación de la muestra ( Tg ' ) debería, por definición, exhibir la misma alta viscosidad que Tg [ FOOD RESEARCH INTERNATIONAL; Bai,Y; 34(2-3):89-95 (2001) ]. La T g ' estará por debajo de la temperatura eutéctica [QUÍMICA PURA Y APLICADA; Goff,HD; 67(11):1801-1808 (1995) ]. Las mezclas de aminoácidos básicos con ácidos hidroxidicarboxílicos agregados al soluto de proteína pueden elevar la Tg ' mediante la creación de redes de enlaces de hidrógeno [ BOLETÍN QUÍMICO Y FARMACÉUTICO; IzutsuK; 57(1):43-48 (2009) ]. Si se forma hielo en una mezcla destinada a vitrificar, como en un paciente de criónica con perfusión imperfecta, la mezcla de vitrificación que queda en la porción no congelada tendrá una concentración más alta y, por lo tanto, una T g más alta (que será T g ' ) [ Figura 1; CRIOBIOLOGIA; Guau, B; 60(1):11-22 (2010)]. 57(1):43-48 (2009) ].
tercero BLOQUEADORES DE HIELO (INCLUYENDO PROTEÍNAS ANTICONGELANTES)
![[ nucleación y temperaturas de fusión ]](https://benbest.com/cryonics/nucleate.gif)
La otra fuente de asistencia para la vitrificación proviene de los bloqueadores de hielo . Mientras que los crioprotectores retardan el crecimiento y la formación de cristales de hielo, los bloqueadores de hielo actúan específicamente contra la formación de los núcleos de hielo que son necesarios para que comience la congelación. Los peces del Ártico utilizan proteínas que bloquean el hielo para mantener la temperatura de congelación de sus cuerpos a -2,2 ºC o menos, que es inferior a la temperatura de congelación del agua de mar (-1,9 ºC). Algunos glucósidos flavonales de plantas pueden reducir la temperatura de congelación hasta en 9ºC [ CRIOBIOLOGÍA; Kyosuke, J; 60(2):240-243 (2010) ].
Aunque la temperatura de fusión del agua es de 0ºC, el agua que es absolutamente pura no se congelará por encima de -40ºC porque el agua requiere agentes nucleantes para comenzar el crecimiento cristalino [ TRANSACCIONES FILOSÓFICAS DE LA SOCIEDAD REAL DE LONDRES; Lundheim,R; 357:937-43 (2002) ]. El agua del grifo tiene suficientes agentes nucleantes que las bandejas de hielo en los refrigeradores pueden congelar el agua a cerca de 0ºC. El agua con pequeñas cantidades de agentes nucleantes se puede sobreenfriar, pero una vez que los cristales de hielo comienzan a formarse, se propagan a una velocidad explosiva.
La temperatura a la que se congelará el agua pura (−40 ºC) se denomina temperatura de nucleación homogénea ( T h ) — en contraste con T m , que es la temperatura de fusión (0 ºC). Las temperaturas entre T h y T m son la región de nucleación heterogénea , donde la formación de hielo es una función del tiempo y la concentración del agente nucleante (o la capacidad nucleante de los nucleadores).
La nucleación heterogénea toma su nombre del hecho de que el núcleo alrededor del cual se produce el crecimiento de los cristales de hielo está compuesto tanto por moléculas de agua como por otros tipos de moléculas. Por el contrario, en la nucleación homogéneala única molécula que se encuentra en el núcleo del cristal es el agua. La cuerda que se usa para hacer caramelo de roca a partir de una mezcla refrescante de agua y azúcar supersaturada actúa como un nucleador heterogéneo alrededor del cual las moléculas de azúcar pueden cristalizar. A temperaturas cercanas a los −40ºC en el cielo (en las regiones polares y por encima de los 30.000 pies), se produce una nucleación homogénea siempre que exista una concentración suficiente de vapor de agua. El yoduro de plata (AgI) es insoluble en agua y tiene una estructura cristalina lo suficientemente similar al hielo que puede actuar fácilmente como un nucleador heterogéneo por debajo de -5ºC. El yoduro de plata es especialmente adecuado para sembrar nubes de lluvia porque puede micronizarse en partículas de menos de 10 nanómetros.
El tamaño crítico para que un núcleo homogéneo comience a crecer cristales de hielo es de 45.000 moléculas de agua a -5ºC, 650 moléculas de agua a -20ºC y solo 70 moléculas de agua a -40ºC [Vali,G; "Principios de la nucleación del hielo" en NUCLEACIÓN BIOLÓGICA DEL HIELO Y SUS APLICACIONES, p.5; Richard E. Lee, Jr., et. otros, Editores; Prensa APS (1995)]. La espectroscopia vibratoria indica el inicio de una estructura similar al hielo para el agua en fase gaseosa en alrededor de 275 moléculas [ CIENCIA; Pradzynski, CC; 337:1529-1532 (2012)]. Por debajo del tamaño crítico se producirá la disolución espontánea de los núcleos de hielo debido a la solubilidad. Así, la temperatura de nucleación homogénea es función del volumen de la muestra y del tiempo. Pero la función es exponencial, con la nucleación disminuyendo tan rápidamente por encima de los −40 ºC que rara vez se ve más allá de unos pocos grados por encima de los −40 ºC [ CRIOBIOLOGY 41(4):257-279 (2000) ]. La probabilidad de que un volumen V de agua pura se congele en el tiempo Δt debido a la nucleación homóloga es J(T) x V x Δt . J(T) es la tasa de nucleación a la temperatura T , determinada por la ecuación derivada empíricamente:
J(T) = 6,8 x 10 −50 e −3,9T
para J(T) en metros 3 /segundo y T en ºC [Vali,G; Ibídem; pág. 4]. El factor e −3.9T significa que la probabilidad de nucleación aumenta alrededor de 50 por cada caída de 1ºC, o más de 6 millones (50 4 ) por una caída de temperatura de 4ºC. Aunque el volumen y el tiempo son componentes lineales en la probabilidad, el componente de temperatura exponencial significa que la probabilidad pasa rápidamente de cero a uno en el rango de temperatura entre −38ºC y −42ºC (muy cerca de −40ºC para todos los efectos prácticos).
No es sorprendente que la probabilidad de nucleación heterogénea en un animal aumente con el tamaño corporal (volumen). Algunas especies de reptiles con una masa corporal inferior a 20 gramos pueden sobreenfriarse a temperaturas por debajo de -5ºC, pero ningún reptil con una masa corporal superior a 40 gramos puede sobreenfriarse hasta -2ºC [Costanzo,JP & Lee,RE,Jr.; "Superenfriamiento y nucleación de hielo en ectotermos de vertebrados" en NUCLEACIÓN BIOLÓGICA DE HIELO Y SUS APLICACIONES, p.229; Richard E. Lee, Jr., et. otros, Editores; Prensa APS (1995)].
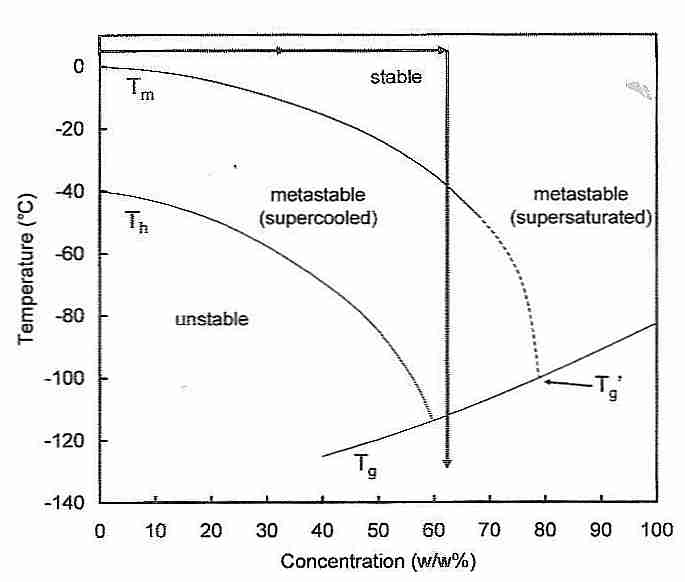
Las presiones más altas reducen Th y elevan Tm [ CRYOBIOLOGY 21(4):407-426 (1984) ]. El aumento de las concentraciones de crioprotector reduce tanto la Th como la Tm , pero el efecto es más drástico en la Th que en la Tm . Como muestra la flecha de dos puntas en la figura, una cantidad suficiente de crioprotector para reducir la T m en 30 ºC reducirá la T h a la temperatura de transición vítrea (T g) — eliminando así la nucleación homogénea. El uso de bloqueadores de hielo para evitar la nucleación heterogénea crea la posibilidad de eliminar la nucleación (formación de hielo) por completo y lograr la vitrificación con una concentración de crioprotector de aproximadamente el 55 %.
La flecha doble que se muestra en el diagrama sirve para centrar la atención en otro fenómeno que debe abordarse al intentar la crioconservación de tejidos. Es decir, que la nucleación máxima ocurre justo por encima de T g cerca de la flecha que apunta hacia abajo (-80 ºC a -120 ºC) y que la tasa máxima de crecimiento de los cristales de hielo ocurre justo por debajo de T m cerca de la flecha que apunta hacia arriba (-80 ºC a -40 ºC) . (La ubicación de las puntas de flecha no es significativa). La importancia de estos hechos es que es mucho más fácil evitar la formación de cristales de hielo cuando se enfría (vitrifica) que cuando se recalienta (desvitrifica). Los muchos núcleos que se forman cuando se enfría en el rango de -80ºC a -120ºC pueden causar un crecimiento masivo de hielo cuando se recalienta en el rango de -80ºC a -40ºC. Esto se llama elproblema de desvitrificación . Antes del uso de bloqueadores de hielo, se creía que solo la tecnología de recalentamiento por radiofrecuencia podría alcanzar tasas de recalentamiento lo suficientemente rápidas como para evitar la formación de cristales de hielo tras la desvitrificación. Sin embargo, con los bloqueadores de hielo, el crecimiento de cristales de hielo se inhibe en gran medida durante el recalentamiento.
Los cristales de hielo pueden crecer a lo largo de seis ejes simétricos: los ejes a , los seis ejes en el mismo plano, o el eje c , que es perpendicular al plano de los seis ejes a. El crecimiento de cristales de hielo a temperaturas más altas ocurre típicamente a lo largo de los ejes a, lo que explica la forma hexagonal familiar de los copos de nieve. El crecimiento del eje C da como resultado cristales de hielo espiculares en forma de aguja, que son potencialmente dañinos [ THE FASEB JOURNAL; Davis, PC; 4(8):2460-2468 (1990) ]. (Para obtener más detalles sobre la formación de hielo, consulte El proceso de congelación.) Los bloqueadores de hielo pueden actuar mediante tres mecanismos: (1) se unen e inactivan sustancias nucleantes heterogéneas, (2) bloquean el crecimiento del eje a o (3) bloquean el crecimiento del eje c. En las proteínas anticongelantes, los aminoácidos como la treonina y la serina se unen al hielo mediante puentes de hidrógeno [ CRYOBIOLOGY 41(4):257-279 (2000) ]. La inhibición del crecimiento del eje a por las proteínas anticongelantes se encuentra típicamente en los peces del Ártico. Los insectos del Ártico, por el contrario, suelen tener proteínas anticongelantes que inhiben el crecimiento del eje c. Al unirse al plano basal (eje c) en lugar del plano del prisma (eje a), las proteínas anticongelantes de insectos pueden reducir la temperatura de congelación entre 4 y 5 °C, mientras que las proteínas anticongelantes de pescado solo reducen la temperatura de congelación no mucho más. de 1ºC [ REVISTA BIOFÍSICA; Pertaya,N; 95(1):333-341 (2008) ].
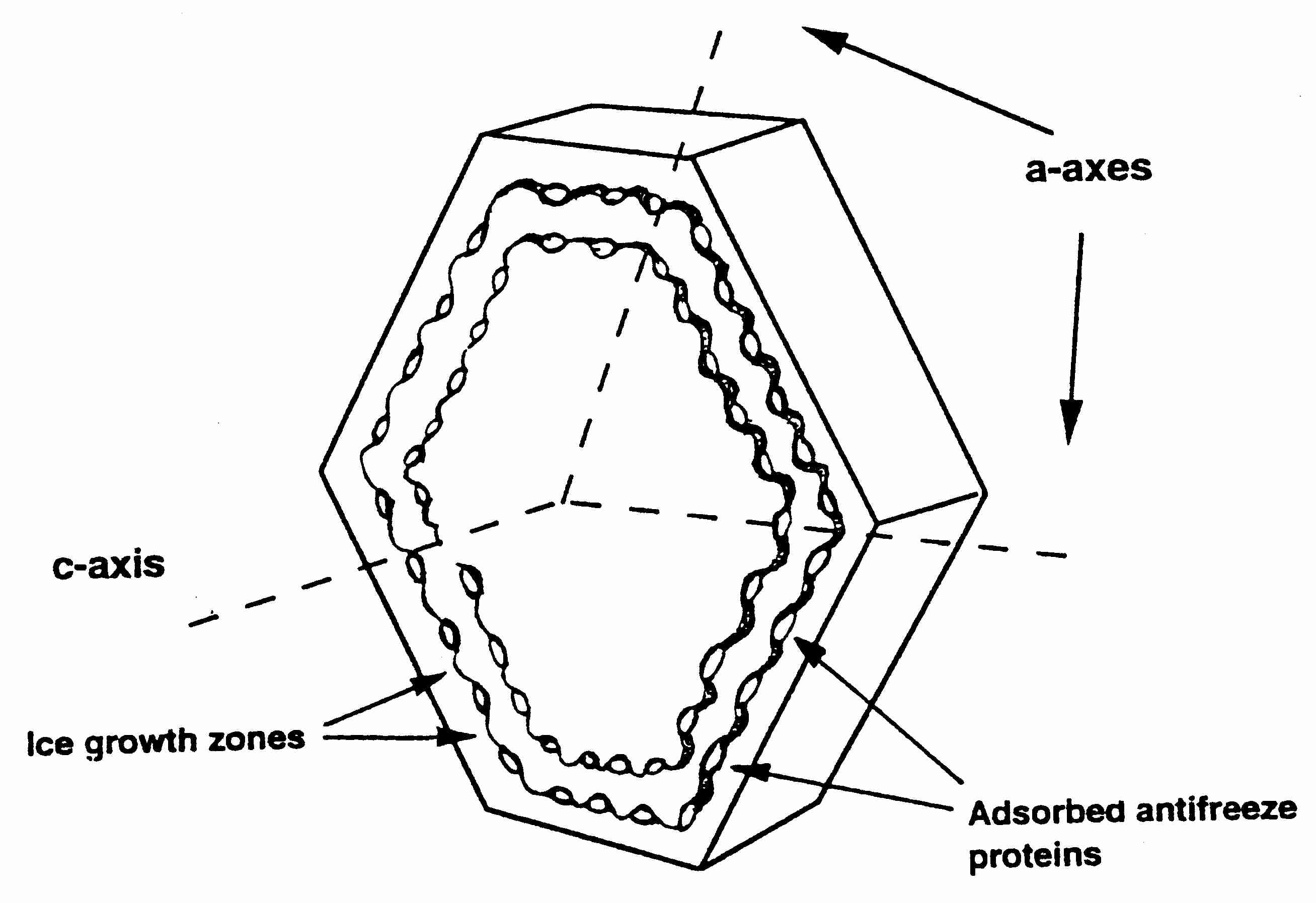 |
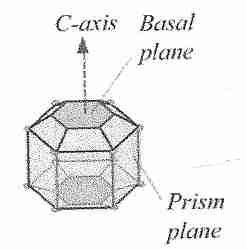 |
No todos los bloqueadores de hielo son proteínas. De hecho, los investigadores de 21st Century Medicine (21CM) han descubierto que el polímero de alcohol polivinílico (comúnmente encontrado en adhesivos como el pegamento de Elmer y el pegamento de sellos postales) es un bloqueador de hielo extremadamente efectivo si se usa en la forma estereoquímica sindiotáctica. En la forma estereoquímica isotáctica , los grupos hidroxilo están todos en el mismo lado de la molécula, mientras que en la forma estereoquímica sindiotáctica , los grupos hidroxilo están en lados alternos de la molécula.
OH OH OH
| | |
-CH 2 -C-CH 2 -C-CH 2-C-CH 2 -C-CH 2 -C-CH 2 -C- (ALCOHOL POLIVINÍLICO)
| | |
OH OH OH
El alcohol polivinílico en la forma estereoquímica sindiotáctica es un excelente ajuste (tamaño y conformación) para adherirse a una superficie de cristal de hielo. Cada grupo hidroxilo del alcohol polivinílico formará enlaces de hidrógeno con una molécula de agua. Las moléculas de alcohol polivinílico se adhieren a los cristales de hielo (evitando el crecimiento) a temperaturas de hasta -30 ºC, por encima de las cuales la temperatura de separación comienza a ocurrir y la actividad de bloqueo del hielo disminuye. El alcohol polivinílico es más efectivo contra el crecimiento del eje c, y más efectivo en el rango de temperatura de nucleación máxima.
Los investigadores de 21st Century Medicine han producido un copolímero patentado (mezcla de polímeros) que consta de 20 % de acetato de vinilo y 80 % de alcohol vinílico que ahora venden como el producto comercial Supercool X-1000 . Se cree que el acetato de vinilo reduce la autoasociación del alcohol vinílico, haciendo que este último esté más disponible para bloquear el hielo [ CRYOBIOLOGY 40(3):228-236 (2000) ]. Una solución al 0,01 % de X1000 puede reducir la cantidad de glicerol necesaria para vitrificar en un 3 %. Una solución al 1% de X1000 puede reducir la cantidad de glicerol necesaria para vitrificar en un 5%. Las concentraciones de X1000 superiores al 1% no brindan muchos beneficios adicionales.
Aunque estas diferencias porcentuales pueden parecer pequeñas, los beneficios de los bloqueadores de hielo son realmente muy grandes. La toxicidad aumenta exponencialmente a medida que las concentraciones de crioprotector alcanzan los altos niveles necesarios para vitrificar. De particular relevancia para la criónica , sin embargo, es el hecho de que los crioprotectores se vuelven demasiado viscosos para perfundir bien en altas concentraciones, mientras que los bloqueadores de hielo aumentan poco la viscosidad. Por lo tanto, el bloqueador de hielo más el crioprotector pueden producir una solución que puede perfundir y vitrificar.
La presencia generalizada de nucleadores biológicos en el medio ambiente hace que el agua se congele cerca de los 0ºC en lugar de a -40ºC. El nucleador más abundante y ampliamente distribuido es la proteína en la superficie de la bacteria Pseudomonas syringae , un tipo de bacteria que causa daños tempranos por congelación en las plantas (más comúnmente se encuentra en las hojas de las plantas y otras partes de las plantas sobre el suelo) [ TRANSACCIONES FILOSÓFICAS DE LA SOCIEDAD REAL DE LONDRES; Lundheim,R; 357:937-943 (2002) y MICROBIOLOGÍA APLICADA; Maki, LR; 28(3):456-459 (1974) ]. Dichas proteínas deben adoptar una conformación rígida similar al hielo de más de 10 nanómetros y poder agregarse [JOURNAL OF MOLECULAR BIOLOGY; Kajava,A; 232(3):709-717 (1993)].
Los investigadores de 21st Century Medicine han logrado encontrar un bloqueador de hielo que se une específicamente a los agentes nucleantes heterogéneos y los inactiva. (Estas proteínas evolucionaron específicamente para provocar la congelación a la temperatura más alta posible). El polímero lineal poliglicerol (PGL) se une e inactiva estas proteínas y es complementario a la acción del alcohol polivinílico (PVA). El PGL no es efectivo para inhibir la nucleación en pequeños volúmenes, pero es más efectivo que el PVA para suprimir los eventos iniciales de nucleación de hielo en grandes volúmenes. El número más bajo de eventos visibles de nucleación de hielo se logra con 0,1 % de PGL y 0,9 % de PVA [ CRIOBIOLOGÍA 44(1):14-23 (2002) ]. (El PVA también puede unirse a agentes de nucleación heterogéneos). 21CM ahora comercializa esta formulación como Supercool Z-1000 .
Los bloqueadores de hielo no pueden atravesar las membranas celulares y no atraviesan una barrera hematoencefálica intacta, lo que significa que para un paciente criónico en buenas condiciones, la única parte del cerebro que contiene bloqueador de hielo será la vasculatura (alrededor del 4 % del cerebro). No se necesitan bloqueadores de hielo dentro de las células porque las células contienen pocos nucleadores; la difusión crioprotectora en las células es adecuada. Los bloqueadores de hielo en la vasculatura cerebral podrían evitar que se formen cristales de hielo en los vasos sanguíneos que podrían propagarse a través de la barrera hematoencefálica, especialmente en áreas que están débilmente perfundidas debido a la mala circulación. La circulación es a menudo muy pobre en pacientes con criónica y la barrera hematoencefálica se daña con frecuencia. Aunque la perfusión deficiente y la concentración reducida de crioprotector representan un peligro de formación de hielo,
Como nota de precaución, debe mencionarse que el uso de un bloqueador de hielo sin suficiente crioprotector (o enfriamiento lo suficientemente rápido) para provocar la vitrificación puede resultar en la formación de hielo que es más dañino que el hielo que se habría formado a una temperatura más alta si no Se ha utilizado bloqueador de hielo. La formación de hielo a mayor temperatura tiende a ser extracelular y deshidrata las células. A temperaturas más bajas, la ósmosis es menos activa. Entonces, si los bloqueadores de hielo simplemente dan como resultado la formación de hielo a una temperatura más baja, es más probable que el hielo que se forma a esas temperaturas esté dentro de las celdas, causando así un daño mayor.
IV. CRIOPRESERVACIÓN DE CÉLULAS, TEJIDOS Y ÓRGANOS
En 1949 se descubrió que el glicerol se puede utilizar para proteger el esperma de toro contra daños por congelación. Un año más tarde, las mismas técnicas se aplicaron con éxito a los glóbulos rojos. Desde entonces se han desarrollado grandes industrias en torno a la criopreservación de esperma de toro y sangre humana.
En 1959 se demostró que la sustancia DiMethyl SulfOxide (DMSO) era útil como crioprotector. El DMSO atraviesa las membranas celulares más fácilmente que el glicerol, pero puede ser más tóxico a temperaturas más altas. En 1972, se crioconservaron embriones de ratón de 8 células a temperatura de nitrógeno líquido y se recalentaron para obtener ratones vivos, gracias al enfriamiento lento y la hábil combinación de DMSO con glicerol. Primero se introduce glicerol, el embrión se enfría a una temperatura baja y luego se puede introducir el DMSO altamente permeable con un efecto tóxico mínimo.
En 1983, Trounson & Mohr estableció por primera vez un embarazo humano utilizando un embrión humano de 8 células, que había sido crioconservado a temperatura de nitrógeno líquido utilizando concentraciones gradualmente crecientes de DMSO, dando tiempo para el equilibrio para evitar el daño osmótico (PBI 10 minutos, 0,25 M DMSO 10 minutos, 0,5 M DMSO 10 minutos, 1,0 M DMSO 10 minutos, 1,5 M DMSO 10 minutos) [FERTILIDAD Y ESTERILIDAD 46(1):1-12 (1986)].
Desde 1983 , los embriones humanos se han criopreservado no solo con DMSO, sino también con glicerol y propilenglicol. Las mejores tasas de supervivencia de embriones se encuentran en la etapa de desarrollo de 2 a 4 células. Nadie sabe exactamente cuántos embriones humanos se están criopreservando en todo el mundo, pero son al menos un millón. Y el número de niños vivos que alguna vez fueron embriones a temperatura de nitrógeno líquido es de decenas de miles. (Para una revisión en línea de la tecnología de criopreservación de embriones humanos, consulte Criopreservación de ovocitos y embriones humanos ).
Más del 50% de las larvas del gusano nematodo ( C. elegans ) y alrededor del 3% de los nematodos adultos pueden sobrevivir al enfriamiento a la temperatura del nitrógeno líquido. El protocolo requerido es un pretratamiento con DMSO al 5% a 0ºC durante 10 minutos, enfriamiento de 0ºC a −100ºC a 0,2ºC/minuto, inmersión en nitrógeno líquido (−196ºC) y finalmente recalentamiento a −10ºC a una velocidad de 27,6ºC /minuto. [ CRIOBIOLOGÍA 12(5):497-505 (1975) ]. Esto es particularmente digno de mención en la medida en que los nematodos son organismos en pleno funcionamiento con un sistema digestivo, órganos reproductivos, músculos y un sistema nervioso que consta de aproximadamente 300 neuronas.
En un órgano con un contenido tan alto de agua y grasa como el cerebro, se esperaría que la perfusión adecuada para proteger las relaciones muy delicadas de célula a célula (conexiones sinápticas) fuera especialmente difícil de lograr. Sin embargo, se sabe desde la década de 1950 que los cerebros tienen cierta tolerancia a la cristalización del hielo. Audrey Smith [PROC. ROYAL SOCIETY B 145:427-442 (1956) y BIOLOGICAL EFFECTS OF FREEZING AND SUPERCOOLING, AUSmith, Ed., p.304-368] demostraron que los hámsters podían enfriarse lentamente hasta casi -1ºC de modo que más del 60 % del agua del cerebro se se convirtió en hielo cristalino, sin una gran pérdida del comportamiento normal al recalentarse. El mecanismo de este efecto se basa en el hecho de que la cristalización del hielo intracelular y las concentraciones elevadas de sal intracelular causan el mayor daño. Cuando los tejidos se enfrían lentamente, la cristalización extracelular comienza primero, y el agua tiende a migrar fuera de las células para congelarse en el espacio extracelular. Si las concentraciones de electrolitos intracelulares aumentan, evidentemente no es suficiente para causar un daño neurológico observable al nivel del 60%.
[Para investigaciones más recientes sobre la crioconservación de tejido cerebral, consulte The Hippocampal Slice Cryopreservation Project ].
V. CRIOPRESERVACIÓN DE ÓRGANOS Y PACIENTES CRYONICS UTILIZANDO GLICEROL
El glicerol crioprotector se ha utilizado durante mucho tiempo para vitrificar sangre y esperma humanos, y durante muchos años se utilizó para reducir la congelación en pacientes con criónica humana. El glicerol no se puede utilizar para vitrificar completamente órganos o pacientes con criónica porque no es posible perfundir órganos con concentraciones lo suficientemente altas de glicerol para vitrificar completamente. Cuando la perfusión se realiza con glicerol puro, entra suficiente glicerol en los tejidos para lograr una vitrificación parcial con aproximadamente un 20 % de formación de hielo.
La crioconservación de tejidos y órganos es mucho más difícil que la crioconservación de pequeñas colecciones de células. Se requiere tiempo para que el crioprotector penetre en un órgano y también para que penetre la temperatura. El tejido está sujeto a degradación si no hay circulación sanguínea, incluso si la temperatura es muy baja; sin embargo, una temperatura muy baja reducirá la velocidad de perfusión del crioprotector. Además, los órganos pueden dañarse incluso por cantidades extremadamente pequeñas de formación de hielo debido a las relaciones críticas de célula a célula que deben mantenerse para un funcionamiento adecuado. Aun así, se han utilizado crioprotectores para preservar la médula ósea, los corazones fetales, los intestinos, las glándulas paratiroides, la piel, los bazos, las glándulas del timo, etc., que se han enfriado lentamente a temperatura de hielo seco (−79 ºC), todo sin dañar los cristales de hielo.
La cristalización no es una consecuencia inevitable del enfriamiento con glicerol. Una solución de glicerol/agua al 68 % v/v (volumen/volumen) no cristalizará a ninguna temperatura bajo cero; simplemente se endurece como el vidrio. Pero las concentraciones de glicerol mucho mayores que el 55 % v/v se han considerado demasiado viscosas y tóxicas para el uso de la criónica. Poco antes de que Alcor comenzara a usar soluciones de vitrificación, el criobiólogo Brian Wowk determinó que una combinación de 58,4 % v/v (8 molar) de glicerol y 1 % de bloqueador de hielo X1000 podía vitrificar un matraz de 2 litros, lo que presumiblemente significa que un cerebro podría vitrificarse con 8 Glicerol molar y bloqueador de hielo X1000 al 1%.
La mayoría de los tejidos pueden tolerar tener más del 80 % del agua en forma de cristales de hielo al enfriarse lentamente sin que se noten daños al volver a calentarse. La mayoría de los órganos pueden tolerar el 40 % del agua en forma de cristales de hielo sin sufrir daños al volver a calentarse. Como se mencionó anteriormente, el cerebro es un órgano especialmente tolerante a los cristales de hielo, en la medida en que el 60% de agua en forma de cristales de hielo causa poco daño grave.
Los experimentos de I.Suda [NATURE 212:268-270 (1966) y BRAIN RESEARCH 70:527-531 (1974)] indican que cerebros de gato enfriados a -20ºC en glicerol al 15% v/v (62% agua de cerebro en forma de hielo ) durante 777 días y 7,25 años, ambos muestran patrones de EEG de aspecto normal tras el recalentamiento, aunque la actividad neurológica es menor para los cerebros de 7,25 años. La hemorragia y la pérdida de células de estos especímenes probablemente podrían haberse evitado usando varias medidas: (1) adición de glucosa (nutriente) al líquido de perfusión, (2) lavado cuidadoso del glicerol de los cerebros como parte del proceso de descongelación/reperfusión y ( 3) almacenar los cerebros a temperaturas más bajas con concentraciones de glicerol más altas.
De acuerdo con un excelente artículo que describe las soluciones de vitrificación (crioprotectoras) [ CRYOBIOLOGY 24:196-213 (1987) ], la cantidad de glicerol (C), en % v/v, necesaria para evitar lesiones mecánicas por hielo a cualquier temperatura bajo cero es:
C = 68 - 0,68P
donde "P" es el porcentaje del volumen líquido de un órgano que se puede convertir en hielo sin dañar los cristales. Esta fórmula es la ecuación de la línea en la Figura 3 del artículo. Está relacionado con el hecho de que una mezcla de 68% de glicerol y 32% de agua (volumen/volumen) vitrificará completamente.
Usando el hallazgo de que al menos el 60% del cerebro se puede congelar sin daño neurológico, da:
C = 68 - 0,68 (60) = 27,2
es decir , un 27,2 % v/v de glicerol (3,72 molar) debería ser suficiente para evitar el daño de los cristales de hielo en los cerebros enfriados a cualquier temperatura bajo cero (incluida la temperatura del nitrógeno líquido, −196 ºC). De hecho, los cerebros de conejo perfundidos a temperatura ambiente con 23% v/v de glicerol (3 Molar) y enfriados a temperatura de hielo seco (−79ºC) muestran una excelente conservación histológica bajo un microscopio óptico [ CRYOBIOLOGY 21(4):407-426 (1984) ) ]. Durante años, los crionicistas creyeron que el "criterio de Smith" de una concentración mínima de glicerol de 3,72 molar podría ser adecuado para prevenir el daño por congelación en pacientes con criónica.
[NOTA: El glicerol es 1,2,3-propanotriol y tiene un peso molecular de 92,09 gramos/mol y una densidad de 1,2613 gramos/cm 3 a 20ºC. Por lo tanto, para convertir la molaridad del glicerol en % v/v, multiplique por 7,30]
En la edición de diciembre de 1991 de la revista CRYONICS, un criobiólogo describió los resultados de un experimento con un solo cerebro de conejo perfundido a temperatura ambiente con glicerol 3,72 molar, enfriado a -130ºC, cortado en placas y las placas resultantes almacenadas a -78ºC durante muchos meses antes del examen bajo un microscopio electrónico. Afirma: "... el patrón de formación de hielo parece ser potencialmente bastante dañino. Dondequiera que uno mire, se encuentran gruesas capas de hielo que se abren paso a través del tejido cerebral con aparente abandono".
Pero si esto es cierto, ¿cómo podemos explicar la recuperación neurológica completa de los hámsters de Audrey Smith, cuyo agua cerebral había sido hielo en un 60%? Cuando se le hizo esta pregunta, el criobiólogo no pudo dar una respuesta. También escribió: "Bioquímicamente, todas las funciones medidas hasta la fecha siempre han sobrevivido a la congelación y descongelación, incluso en circunstancias adversas, nuevamente en posible desacuerdo con los resultados deficientes del microscopio electrónico (EM). Por lo tanto, la realidad de los resultados de EM y la posibilidad de Los artefactos en estos resultados han estado en duda durante algún tiempo". Continúa diciendo: "Es casi milagroso lo bien que se restablece la organización del tejido en general después de la descongelación, incluso en áreas donde hay brechas. Sin embargo, la probabilidad de que exista un daño extenso por debajo del nivel de resolución del microscopio óptico ,
Aunque se debe tener cierta cautela al aceptar los resultados de una sola preparación de cerebro de conejo por un solo experimentador, las observaciones del criobiólogo no son del todo incompatibles con las de Audrey Smith. Como se esperaba, la congelación observada fue extracelular, en lugar de intracelular. Pero el daño visto no solo parece inconsistente con la recuperación neurológica completa de los hámsters de Audrey Smith, también parece inconsistente con el hallazgo de que incluso sincrioprotectores, el 80 % de las sinapsis en tejidos cerebrales completos enfriados a -70 °C retienen las propiedades metabólicas de las sinapsis de biopsia cerebral fresca ["Metabolically Active Synaptosomes can be Prepared from Frozen Rat and Human Brain", JOURNAL OF NEUROCHEMISTRY 40:608-614 (1983) ]. ¿Será que el crioprotector de glicerol contribuye de alguna manera al daño extracelular? En cualquier caso, concentraciones de glicerol por encima de 3,72 Molar (27,2%v/v) de glicerol no son difíciles de conseguir en criónica. Los crionicistas suelen estar más preocupados por eliminar el daño estructural que por la pérdida de viabilidad debido a la toxicidad de los crioprotectores. A altas concentraciones, el glicerol penetra mal en las células y extrae agua osmóticamente de las células, lo que provoca deshidratación.
Tras la evidencia ultramicroscópica de daño intracelular, las organizaciones de criónica Alcor y más tarde CryoCare comenzaron a perfundir a los pacientes con las concentraciones más altas posibles de glicerol. Los pacientes de Cryonics se deshidrataron mucho (perdieron volumen corporal) con este procedimiento. La alta viscosidad del glicerol solo permitía una concentración máxima del 55 % v/v (7,5 molar), muy por debajo del 68 % v/v necesario para la vitrificación. Sin embargo, se ha estimado que, en combinación con bloqueadores de hielo, el glicerol 8 molar podría vitrificar, si tan solo se pudiera alcanzar tal concentración de glicerol en pacientes humanos. (Los pacientes de criónica ahora suelen recibir una perfusión de crioprotectores vitrificantes en lugar de glicerol).
A menudo, un paciente de criónica ha sido perfundido con glicerol en un lugar y enviado en hielo seco (dióxido de carbono congelado) para su almacenamiento en otro lugar. La temperatura de solidificación (T g ) del glicerol es de −90 ºC, que está por debajo de la temperatura del hielo seco (−79 ºC). Pero el glicerol es lo suficientemente viscoso a la temperatura del hielo seco por lo que resulta poco daño mantener al paciente glicerolizado en hielo seco durante unos días. Sin embargo, el resultado puede ser muy dañino si se permite que el hielo seco se derrita y el paciente se recalienta. La porción líquida de un paciente glicerolizado es aproximadamente un 20% de agua y aproximadamente un 80% de glicerol. Como puede verse en el diagrama al comienzo de la sección sobre la temperatura de fusión de los bloqueadores de hielo (T m) disminuye rápidamente con el aumento de la concentración de crioprotector. En un paciente glicerolizado se produce un derretimiento considerable del hielo a −60ºC y más. La fusión libera los desechos creados por la congelación y, por lo tanto, provoca la pérdida de información estructural que podría ser utilizada por la futura tecnología de reparación molecular. Además, la toxicidad de los crioprotectores puede provocar daños estructurales en los desechos y tejidos dañados, lo que es mucho peor al recalentarse que lo que ocurriría al pasar por las mismas temperaturas al enfriarse. Por lo tanto, se debe extremar la precaución para evitar que un paciente glicerolizado se recaliente por la temperatura del hielo seco.
[Para obtener más información sobre la perfusión de pacientes criogénicos con crioprotectores, consulte mi ensayo Perfusión y difusión en el protocolo criogénico ].
VI. CRIOCONSERVACIÓN CON AZÚCARES
La membrana celular (plasmalema) es el sitio de mayor daño por congelación. Por lo tanto, los buenos crioprotectores pueden no solo realizar la función anticongelante de prevenir la formación de hielo, sino también proteger las membranas celulares. Sin embargo, la toxicidad de los crioprotectores puede afectar potencialmente a cualquier orgánulo o macromolécula, siendo las proteínas las más vulnerables.
Los azúcares son polihidroxialdehídos o cetonas (cadenas de carbono con aldehídos o cetonas terminales y cadenas laterales de hidroxilo). El gliceraldehído es un azúcar muy simple. Altos niveles de azúcares y alcoholes de azúcar (polioles) se encuentran en muchas plantas polares, insectos, hongos, etc. como crioprotectores no tóxicos. El hecho de que la fructosa no se cristalice es la razón por la cual la sacarosa se usa como azúcar de mesa, a pesar de que la fructosa es más barata.
Las ranas del norte usan la glucosa como crioprotector. Cuando las temperaturas bajan, los hígados de estas ranas producen grandes cantidades de glucosa que una forma especial de insulina permite que entre en las células en gran cantidad. El corazón y el cerebro no se congelan, pero gran parte del resto del cuerpo sí (la rana es dos tercios de hielo). Al descongelarse, la rana debe eliminar rápidamente la glucosa para evitar lesiones metabólicas, pero la glucosa se guarda en una vejiga especial porque la rana no puede arriesgarse a perder tantas calorías preciosas. Gradualmente, la glucosa de la vejiga especial vuelve a entrar en el plasma para ser metabolizada o almacenada en el hígado [ JOURNAL OF MOLECULAR ENDOCRINOLOGY; Conlón, JM; 21(2):153-159 (1998) ].
Los dos disacáridos (azúcares compuestos de dos azúcares simples simples) que más protegen las proteínas y las membranas celulares contra el enfriamiento, la congelación y la deshidratación son la sacarosa (fructosa, glucosa) y la trehalosa .(glucosa, glucosa). La sacarosa es el azúcar más común que se encuentra en las plantas tolerantes a la congelación, que pueden aumentar diez veces sus niveles de sacarosa en respuesta a las bajas temperaturas. La sacarosa y la trehalosa inhiben la mezcla de membrana asociada con el enfriamiento. Ambos azúcares encajan bien en las membranas celulares, uniéndose a los grupos de cabeza de fosfolípidos. La trehalosa constituye el 20% del peso seco de los organismos capaces de sobrevivir a la deshidratación completa. La trehalosa tiene un radio de hidratación anormalmente grande, más del doble que otros azúcares, y (a diferencia de otros azúcares) está totalmente excluida de la capa de hidratación de las proteínas.
La crioprotección de la lesión por congelación puede diferir de la crioprotección para la vitrificación: reducir la toxicidad de los electrolitos podría ser más importante para la primera, pero no sería tan importante para la segunda. La sacarosa y el etilenglicol se han utilizado en combinación para vitrificar ovocitos humanos [ REPRODUCCIÓN HUMANA; Kuleshova,L; 14(12):3077-3079 (1999) ]. Pero los azúcares se utilizan más a menudo como crioprotectores contra los daños por congelación y frío que para la vitrificación, siendo el disacárido sacarosa más eficaz que el monosacárido glucosa [ CRIOBIOLOGÍA; Santarius, KA; 20(1):90-99 (1983) y CRIOBIOLOGÍA; carpintero,JF; 25(3):244-255 (1988) ].
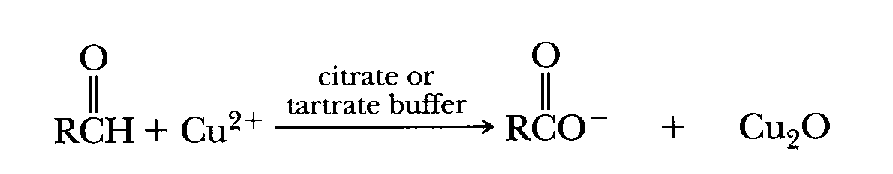 |
Los grupos carbonilo ( >C=O ), como los que se encuentran en los aldehídos ( RCOH ) y las cetonas ( RCOR' ), pueden reducir ciertos iones de metales pesados (es decir, "reducir" la carga positiva agregando un electrón). El ion cobre en el estado más dos (Cu 2+ ), por ejemplo, puede reducirse al estado más uno (Cu + ) en presencia de una cetona o un aldehído. (Los azúcares son cetonas o aldehídos, p. ej., la glucosa es un aldehído y la fructosa es una cetona). Los iones de cobre y hierro en estado reducido pueden provocar la producción de radicales hidroxilo dañinos como resultado de la reacción de Fenton.
 |
Debido a que la mayoría de los azúcares tienen grupos terminales aldehído o cetona libres, se unen fácilmente al grupo amino libre de lisina o arginina en las proteínas, un proceso llamado glicación . Los azúcares que participan en esta reacción se denominan azúcares reductores . Todos los monosacáridos son azúcares reductores porque, aunque el grupo carbonilo puede no estar expuesto cuando se forma una estructura de anillo, el grupo carbonilo está expuesto cuando se abre un anillo hemiacetal (p. ej., en la interconversión de glucosa entre formas anoméricas). Los monosacáridos pueden disolverse en soluciones crioprotectoras más fácilmente y vitrificarse en concentraciones más bajas que los disacáridos [ CRIOBIOLOGÍA; Kuleshova, LL; 38(2):119-130 (1999)], pero debido a su capacidad de glicación, la exposición de los monosacáridos a la proteína debe ser breve y a baja temperatura. Se demostró que una solución de D-galactosa 220 milimolar es casi tan eficaz como crioprotector como el DMSO al 5 % para las células hepáticas embrionarias humanas (y sustancialmente mejor que la D-glucosa) [ GLICOBIOLOGÍA; Chaytor,JL; 22(1):123-133 (2012) ], pero la galactosa puede ser cinco veces más glicosiladora que la glucosa.
Algunos disacáridos (como la maltosa) son azúcares reductores porque el enlace entre los monosacáridos compuestos (el enlace glucosídico ) no evita que se abran los anillos hemiacetal del monosacárido compuesto. Pero la trehalosa y la sacarosa son azúcares no reductores porque sus enlaces glucosídicos impiden la apertura de los enlaces hemiacetal. En condiciones ácidas, sin embargo, la sacarosa es mucho más vulnerable a la hidrólisis en sus monosacáridos de azúcares reductores que la trehalosa [ CRIOBIOLOGÍA; Crowe,JH; 43(2):89-105 (2001) ]. En la medida en que la glicación juega un papel en la estabilidad de la enzima y la estabilidad de la membrana asociada con el daño por congelamiento o daño por frío, la trehalosa es un crioprotector superior a la sacarosa.
| sacarosa | trehalosa |
|---|---|
![[sacarosa]](https://benbest.com/cryonics/Sucrose.gif) | ![[trehalosa]](https://benbest.com/cryonics/Trehalose.gif) |
Sin embargo, los disacáridos como la trehalosa y la sacarosa no atraviesan las membranas celulares y, por lo tanto, solo protegen las membranas celulares internas de los organismos que los sintetizan. La trehalosa permite que la levadura se deshidrate y puede alcanzar hasta el 35% del peso seco. La trehalosa es un azúcar en la sangre de las langostas, pero los vertebrados no la sintetizan. Se han intentado muchas estrategias para obtener trehalosa dentro de las células de vertebrados de modo que sus propiedades crioprotectoras, protectoras de proteínas y protectoras de membrana puedan ser beneficiosas tanto en el interior como en el exterior de las células. Plásmidos que contienen el gen transportador de trehalosa TRET1 de larvas de quironómidos africanos [ ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE.UU.); Kikawada,T; 104(28):11585-11590 (2007)] han sido transfectadas en células de ovario de hámster chino, lo que resultó en un aumento de siete veces en la trehalosa y un aumento del 400 % en el crecimiento después de la desecación [ CRIOBIOLOGÍA; Chakraborty,N; 64(2):91-96 (2012) ]. La microinyección se ha utilizado para introducir trehalosa en ovocitos humanos, lo que mejora la crioconservación [ FERTILITY AND STERILITY 77(1):152-158 (2002) ]. Cuando se combinó con DMSO 0,5 molar, trehalosa 0,5 molar microinyectada en ovocitos de ratón dio como resultado una criosupervivencia excelente y una descendencia saludable (presumiblemente porque la trehalosa sola no entraría en orgánulos como las mitocondrias y el retículo endoplásmico) [ BIOLOGÍA DE LA REPRODUCCIÓN; Eroglu,A; 80(1):70-78 (2009)]. La epidermis modificada por ingeniería tisular trasplantada que se había crioconservado con una mezcla de trehalosa/DMSO no se distinguía de los injertos de control frescos [ BIOMATERIALES; Chen,F; 32(33):8426-8435 (2011) ]. La trehalosa también puede proteger las macromoléculas al ser un eliminador de radicales libres [ JOURNAL OF BIOLOGICAL CHEMISTRY; Benaroudj,N; 276(26):24261-24267 (2001) ].
 |
No obstante, los crioprotectores no penetrantes pueden ayudar a la vitrificación porque la mayoría de los nucleadores son extracelulares y porque la deshidratación permite la vitrificación intracelular por el agua ligada. La vitrificación extracelular que involucra azúcar evita que las membranas celulares entren en contacto y se fusionen [ REVISIÓN ANUAL DE FISIOLOGÍA; Crowe,JH; 60:73-103 (1998) ]. Se cree comúnmente que las membranas celulares son la parte de las células más vulnerable al daño por congelamiento.
La trehalosa desplaza el agua unida y protege las membranas celulares mediante enlaces de hidrógeno a las proteínas y los extremos polares de los fosfolípidos con más fuerza que el agua unida [ ARCHIVES OF BIOCHEMISTRY AND BIOPHYSICS 245(1):134-143 (1986) ]. En la bicapa de fosfolípidos de las membranas celulares, la trehalosa puede desplazar las moléculas de agua unidas a los carbonilos, pero la sacarosa no [ BIOPHYSICAL JOURNAL; Amalfa,F; 78(5):2452-2458 (2000) ]. La trehalosa interactúa más fuertemente con el agua que la sacarosa, al menos en parte porque la sacarosa forma enlaces de hidrógeno intramoleculares [ THE JOURNAL OF PHYSICAL CHEMISTRY B; Lerbret,A; 109(21):11046-11057 (2005)]. La trehalosa tiene un radio de hidratación que es 2,5 veces mayor que el de la sacarosa, y se requiere 2,5 veces la concentración de sacarosa para proporcionar una cantidad equivalente de protección proteica [ ARCHIVOS DE BIOQUÍMICA Y BIOFISICA; Sola-Penna,M; 360(1):10-14 (1998) ]. Las soluciones 1,5 molar de trehalosa y sacarosa contienen 62,5 % y 87 % de agua por volumen, respectivamente. El mayor volumen hidratado de trehalosa reduce el agua congelable y aumenta la viscosidad [ PROTEIN SCIENCE; jainista, NK; 18(1):24-36 (2009)]. Se ha demostrado que la trehalosa es aproximadamente el doble de eficaz que la sacarosa para suprimir el crecimiento de cristales de hielo, evidentemente debido al mayor radio de hidratación [JOURNAL OF CRYSTAL GROWTH; Sei,T; 240(1-2):218-229 (2002)]. A una concentración de trehalosa del 41,7 % en peso, el crecimiento de los cristales es aproximadamente una cuarta parte de lo que es al 20,8 % en peso. Al 52,1% en peso, la velocidad de crecimiento de los cristales de trehalosa disminuye a medida que aumenta el tamaño de los cristales.
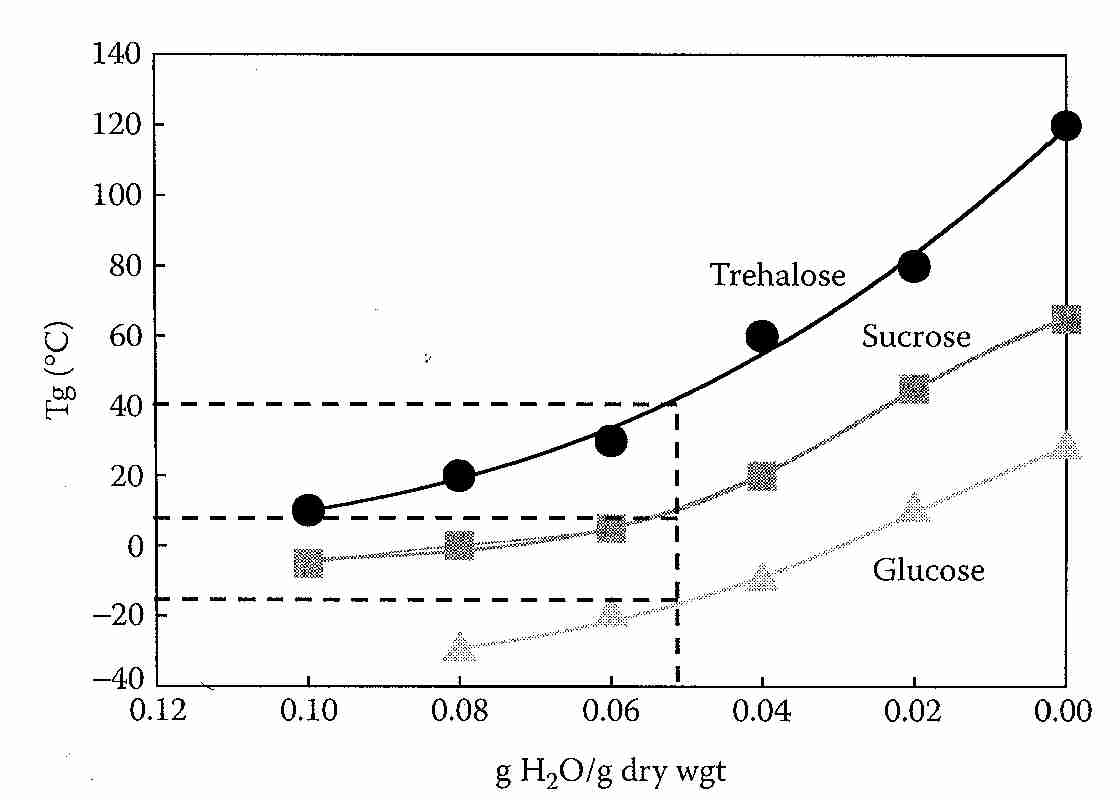
La trehalosa tiene una temperatura de transición vítrea ( Tg ) más alta que la sacarosa o cualquier otro disacárido estudiado. Como grupo, los disacáridos tienen una T g que es, en promedio, unos 60 ºC superior a la de los monosacáridos [ FRONTERAS EN LA BIOSCIENCIA; Furuki,T; 14:3523-3535 (2009) ]. Con un contenido de agua del 5 %, la T g de la trehalosa es de unos 40 ºC, mientras que la T g de la sacarosa es de unos 15 ºC. Después de almacenarse a 44ºC durante 45 días, las muestras de glucosa/sacarosa perdieron completamente su estado amorfo, mientras que menos del 4% de las muestras de glucosa/trehalosa habían cristalizado [ BIOCHEMCIA ET BIOPHYSICA ACTA; Sol,WQ; 1425(1):235-244 (1998) ].
Los disacáridos son ejemplos de la clase de crioprotectores que no atraviesan las membranas celulares: crioprotectores no penetrantes . Los crioprotectores no penetrantes son parcialmente efectivos porque el hielo se forma mucho más fácilmente fuera de las células que dentro de las células debido al hecho de que los agentes nucleantes son mucho más frecuentes fuera de las células que dentro de las células. En general, los crioprotectores no penetrantes son mucho menos tóxicos que los crioprotectores penetrantes. Muchos cócteles de crioprotectores eficaces combinan crioprotectores no penetrantes con crioprotectores penetrantes, lo que reduce la cantidad de crioprotectores penetrantes necesarios. Los crioprotectores no penetrantes actúan parcialmente al inducir la deshidratación celular, reduciendo así la cantidad de hielo que se puede formar en las células. Por ese motivo, los crioprotectores no penetrantes se utilizan en los métodos clásicos de criopreservación que implican la congelación .
Aunque el glicerol crioprotector penetrante se usa ampliamente para la crioconservación de eritrocitos, se han hecho esfuerzos para usar el hidroxietilalmidón ( HES ) crioprotector no penetrante porque HES es un expansor de plasma inofensivo que no sería necesario eliminar de los eritrocitos después del calentamiento y antes de la transfusión. — como se requiere con glicerol. Aunque un estudio concluyó que el aumento de la hemoglobina (aumento de la hemólisis) asociado con los eritrocitos criopreservados sin lavar no es perjudicial [ ANESTESIA Y ANALGESIA; Cuerno,E; 85(4):739-745 (1997) ] las preocupaciones sobre la posible toxicidad renal por el aumento de la hemoglobina han impedido el uso clínico de HES [ TRANSFUSION MEDICINE REVIEWS; Scott, KL; 19(2):127-142 (2005)]. Los eritrocitos conservados en nitrógeno líquido con los crioprotectores no penetrantes trehalosa y Dextrano-40 conservaron su forma y actividad enzimática normales, pero tuvieron una reducción del 56 % en ATP [ CRIOBIOLOGÍA; Pellerin-Mendes,C; 35(2):173-186 (1997) ].
[Para obtener información sobre los azúcares en las lesiones por frío y deshidratación, consulte Viabilidad, toxicidad crioprotectora y lesiones por frío en criónica ].
VIII. VITRIFICACIÓN CON CRIOPROTECTORES SIN GLICEROL
| CPA de poliol | DMSO |
|---|---|
![[Estructuras de poliol CPA]](https://benbest.com/cryonics/polyols.jpg) | ![[DMSO]](https://benbest.com/cryonics/DMSO.jpg) |
|
El glicerol fue el primer agente crioprotector ( CPA ) que obtuvo un uso generalizado en criobiología, para la crioconservación de glóbulos rojos y esperma. El valor del DMSO (dimetilsulfóxido) como CPA se descubrió poco tiempo después. Posteriormente, se demostró que otros polioles, como el etilenglicol (anticongelante para automóviles) y el propilenglicol (anteriormente utilizado para reducir la formación de hielo en los helados), eran crioprotectores eficaces. El glicerol todavía se considera superior para la crioconservación de espermatozoides de casi todas las especies, pero la lactamida da como resultado una motilidad para los espermatozoides de conejo que es casi el doble de la observada para el glicerol [ JOURNAL OF REPRODUCTION AND DEVELOPMENT; Kashiwazaki,N; 52(4):511-516 (2006) ].
Los crioprotectores se evalúan mediante una serie de parámetros, que incluyen la temperatura de transición vítrea ( Tg ), la permeabilidad , la viscosidad, la toxicidad y la concentración necesaria para vitrificar ( Cv ) . Cv es la concentración mínima requerida del CPA particular que se vitrificará, que es una cantidad importante a tener en cuenta porque las concentraciones muy por encima de este mínimo dan como resultado una mayor toxicidad sin un mayor beneficio.
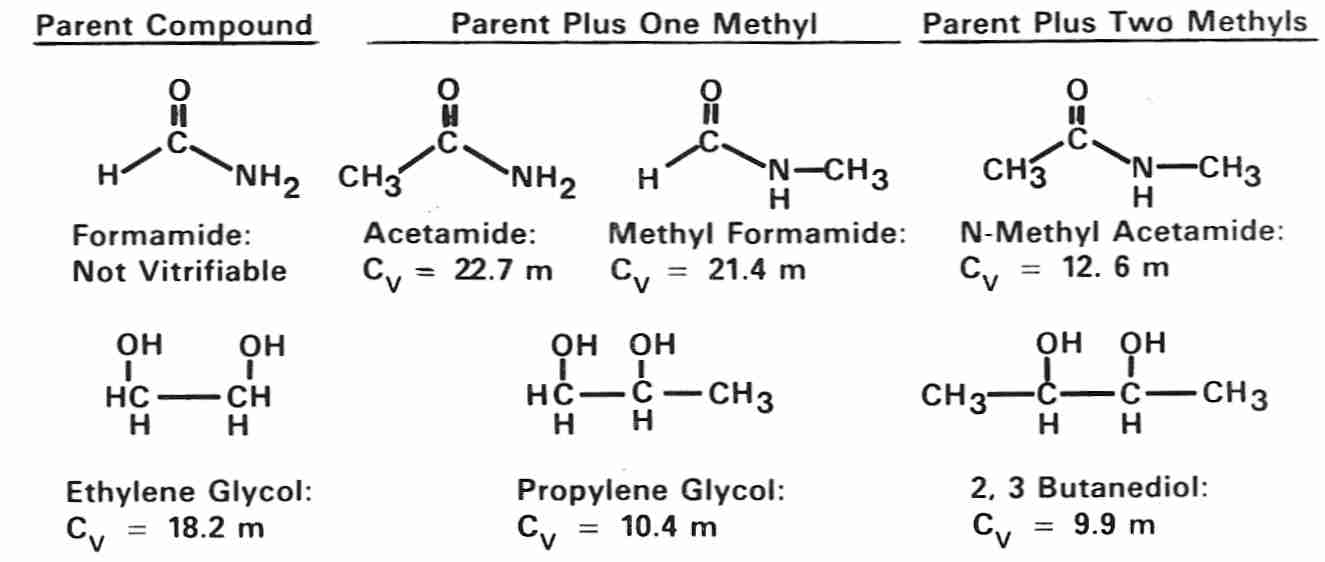
Las amidas son crioprotectores débiles en comparación con los polioles (la formamida es demasiado débil para vitrificarse por sí sola, pero puede ayudar a la vitrificación con otros crioprotectores). Tanto las amidas como los polioles se vuelven crioprotectores más potentes (tienen un Cv más bajo ) mediante la adición de grupos metilo, como puede verse en las estructuras y Cvs de amidas y polioles metilados [de CRIOBIOLOGY ; Fahy, GM; 24(3):196-213 (1987)].
 |
Un estudio de Resonancia Magnética Nuclear (RMN) ha indicado que la metilación aumenta la fuerza de los enlaces de hidrógeno de los grupos polares [ JOURNAL OF PHYSICAL CHEMISTRY; Forsyth,M; 94:6889-6893 (1990) ]. En comparación con el propilenglicol (1,2-propanodiol), el 1,3-propanodiol necesita una concentración más alta para vitrificar (57 % frente a 44 %) y una temperatura de nucleación homogénea más alta para una solución al 20 % p/p (−60 ºC frente a − 68ºC), lo que indica que es más débil e incluso menos tóxico que el etilenglicol en comparación con el propilenglicol [CRIOBIOLOGÍA; MacFarlane,DR; 27:345-358 (1990)]. Se observa una inhibición mucho menor de las disacaridasas con el 1,3-propanodiol en comparación con el propilenglicol [MEDICINA BIOQUÍMICA Y BIOLOGÍA METABÓLICA; 45(2):161-170 (1991)].
Aunque se sabe desde hace mucho tiempo que los polioles son buenos crioprotectores, otros CPA [como los compuestos metoxilados, es decir, CPA en los que se agrega un grupo metilo (-CH 3 ) a un alcohol para hacer un éter] que ahora se están considerando son menos tóxicos y más penetrante. Aparte de los efectos osmóticos , sin embargo, el glicerol es probablemente el CPA que menos daña las membranas celulares , en comparación con el óxido de dimetilsulfuro ( DMSO ), el etilenglicol, el propilenglicol o los compuestos metoxilados, porque es más probable que estos otros compuestos tengan un efecto de disolución. Sin embargo, el glicerol es bioquímicamente tóxico porque el tejido renal no puede someterse a más de 3-4 molares de glicerol sin pérdida de viabilidad.
La toxicidad de los compuestos metoxilados puede ser similar a la del etilenglicol. La membrana del esperma humano, por ejemplo, es 4 veces más permeable al etilenglicol que al glicerol. Y el transporte de membrana del etilenglicol se ve menos afectado por la temperatura que el glicerol [ REPRODUCCIÓN HUMANA; Gilmore,JA; 12(1):112-118 (1997)]. El etilenglicol es tóxico a 38ºC debido al metabolismo a ácido oxálico por la alcohol deshidrogenasa en el hígado. El ácido oxálico puede precipitar como cristales de oxalato de calcio en el cerebro, el corazón, los riñones, los pulmones y el páncreas causando hipocalcemia, y el mayor daño se observa en el riñón (ver PRINCIPIOS DE MEDICINA INTERNA de Harrison). Los compuestos metoxilados pueden tener una toxicidad similar a la de un glicol no esterificado (glicol = alcohol con dos grupos hidroxilo) como el etilenglicol porque se hidrolizan fácilmente. Pero los éteres de glicol pueden tener otros efectos tóxicos, como hemólisis y daño cromosómico (ver TOXICOLOGÍA de Casarett & Doull). Es dudoso, sin embargo, que muchos de estos efectos tóxicos se verían durante la aplicación de un protocolo de criónica, y la sangre se lavaría, lo que evitaría que los metabolitos del hígado lleguen a otras células. Además, el etilenglicol tiene una toxicidad variable: se descubrió que no es tóxico para los embriones de vaca, por ejemplo [REPRODUCCIÓN HUMANA; Gilmore,JA; 12(1):112-118 (1997)] ].
En la medida en que la membrana celular (plasmalema) parece ser la estructura celular que es el objetivo más crítico en el daño por frío y congelamiento, la estabilización de las membranas celulares puede ser un aspecto significativo de la acción crioprotectora. La prolina, la betaína, la sarcosina, el glicerol, el DMSO, la trehalosa y la sacarosa reducen la fusión de membranas. La prolina, la betaína y la sarcosina estabilizan las bicapas de foslipidos mediante interacciones hidrofóbicas. La interacción hidrófoba con las membranas es un medio menos efectivo de estabilización de membranas que los enlaces de hidrógeno de los otros crioprotectores [CRYOBIOLOGY; Anchordoguy,TJ; 24(4):324-331 (1987)].
Los principales crioprotectores se pueden enumerar con respecto a la fuerza vitrificante, la toxicidad y la viscosidad. Puede encontrar una lista de crioprotectores en orden de capacidad de formación de vidrio de soluciones al 45 % (v/v) en [CRIOBIOLOGÍA; Baudot;A; 40(2):151-158 (2000)]:
propilenglicol > DMSO > DMF > 1,4-butanodiol > Etilenglicol > glicerol > 1,3-propanodiol
Los estudios realizados por investigadores de 21st Century Medicine (21CM) en rodajas de riñón han indicado que el orden relativo de toxicidad coincide con el orden de la capacidad de formación de vidrio. La formamida es excepcional, ya que es el CPA más tóxico y tiene la capacidad de formación de vidrio más débil. La mezcla de CPA reduce las toxicidades de muchos de los agentes individuales.
Ordenar los CPA por viscosidad da:
glicerol > Propilenglicol > Etilenglicol > DMSO
Una mezcla crioprotectora con alta capacidad de formación de vidrio, baja toxicidad y baja viscosidad es el objetivo difícil de alcanzar de la investigación de vitrificación.
En la Conferencia de la Sociedad de Criobiología de 2005, 21st Century Medicine anunció que había vitrificado con éxito un riñón de conejo a estado sólido, recalentado el riñón y trasplantado a un conejo con viabilidad completa [ ORGANOGÉNESIS; Fahy, GM; 5(3):167-175 (2009) ]. Un cerebro de conejo ha sido vitrificado con la misma mezcla crioprotectora sin formación de hielo [ANNALS OF THE NEW YORK ACADEMY OF SCIENCE; 1019:559 (2004)]. En ambos casos la mezcla crioprotectora utilizada fue M22 [CRYOBIOLOGY 48:157-178 (2004)], una mezcla crioprotectora al 65% p/v (9,35 M) con una temperatura de fusión de −55ºC y una Tg de −123,3ºC. (M22 recibió este nombre debido a la intención de introducir este cóctel de vitrificación en un espécimen biológico en M inus 22ºC.) El riñón vitrificado se mantuvo a -135ºC durante 4 minutos.
La mayoría de los crioprotectores en M22 son crioprotectores penetrantes (atraviesan las membranas celulares), con la excepción de PVP K12 y (aunque técnicamente no son crioprotectores) bloqueadores de hielo. Los agentes crioprotectores y bloqueadores de hielo utilizados en M22 son:
22 % dimetilsulfóxido
13 % formamida
17 % etilenglicol
3 % N-metilformamida
4 % 3-metoxi-1,2-propanodiol
3 % PVP K12
2 % bloqueador de hielo Z-1000
1 % bloqueador de hielo X-1000
Los crioprotectores no se agregan simplemente al agua, se agregan a una solución portadora isotónica que a menudo puede actuar como una solución de preservación de órganos . La solución portadora utilizada para M22 es LM5 , una mezcla de glucosa, manitol, lactosa, KCl, K 2 HPO 2 , GSH, NaHCO 3 y adenina HCl [ TABLA 1; CRIOBIOLOGIA; Fahy, GM; 48(2):157-178 (2004) ]. Agregar bloqueadores de hielo y reducir la cantidad de glucosa en una solución portadora anterior redujo la tasa de calentamiento requerida para evitar la desvitrificación en más de la mitad. La elección de la solución portadora puede afectar la recuperación del tejido y la composición del líquido tisular también tiene un efecto.CRIOBIOLOGIA; WustermanMC; 56(1):62-71 (2008) ]. M22 se optimizó para cortes de riñón.
La solución crioprotectora utilizada por el Cryonics Institute ( CI−VM−1 ) tiene 35 % de etilenglicol y 35 % de dimetilsulfóxido, un par de crioprotectores que pueden reducir la toxicidad cuando se usan en combinación [ REPRODUCCIÓN, FERTILIDAD Y DESARROLLO; Gautama, SK; 20(4):490-496 (2008) ]. La solución portadora es m-RPS-2, una mezcla de glucosa, KCl, HCl y tampón TRIS. CI−VM−1 es una mezcla crioprotectora más poderosa y mucho menos costosa que M22, pero es más tóxica. CI−VM−1 fue optimizado en cortes de hipocampo por el criobiólogo Dr. Yuri Pichugin .
[Para obtener información sobre la toxicidad de los crioprotectores, consulte TOXICIDADES DE LOS AGENTES CRIOPROTECTORES . Para obtener un análisis/explicación más detallado de M22, consulte Agentes de vitrificación en criónica: M22 . Para obtener una descripción del uso de M22 por parte de Alcor , consulte Nueva tecnología de criopreservación .]
VIII. EL PROBLEMA DE LA DESVITRIFICACIÓN
El problema de la desvitrificación surge del hecho de que el rango de temperatura de nucleación máxima (formación máxima de núcleo) es mucho más bajo que el rango de temperatura de tasa máxima de crecimiento de cristales de hielo. La temperatura máxima de nucleación para M22 está en el rango de -110 ºC a -120 ºC (volviéndose indetectable en ambos extremos a -90 ºC y -140 ºC), mientras que la temperatura máxima de crecimiento de cristales está en el rango de -50 ºC a -60 ºC (volviéndose indetectable en el extremo inferior por −95ºC) [ CRIOBIOLOGÍA; Guau, B; 55:330 (2007) [RESUMEN] ]. Cuando se enfría con crioprotector, el rango de tasa de crecimiento máximo no es motivo de preocupación porque no hay núcleos para crecer. La principal preocupación sobre el enfriamiento es el rango máximo de nucleación, que aumenta cerca de T g. Lo ideal es enfriar lo suficientemente rápido para alcanzar la Tg sin que se formen núcleos . Pero si se forman núcleos, el enfriamiento rápido y la alta viscosidad cerca de T g no permitirán que los núcleos crezcan mucho y, por lo tanto, evitarán que sean muy dañinos.
Los cristales de hielo grandes causan el mayor daño, mientras que los cristales de hielo pequeños causan menos daño y pueden no causar ningún daño durante el enfriamiento si son lo suficientemente pequeños. La situación del recalentamiento es muy diferente a la del enfriamiento. No muy por encima de Tg , primero se debe pasar la temperatura máxima de nucleación . Luego, a medida que la temperatura aumenta aún más, se alcanza el rango de tasa máxima de crecimiento. Habiéndose formado al enfriarse o recalentarse, los diminutos cristales de hielo son los nucleadores ideales para el crecimiento de cristales de hielo con el calentamiento. El crecimiento de cristales de hielo durante el recalentamiento o el enfriamiento excesivamente lento de una solución vitrificada se denomina desvitrificación . El hecho de que el crecimiento de los cristales de hielo sea mucho peor al recalentarse que al enfriarse se denomina problema de desvitrificación., aunque la desvitrificación de un vidrio puede ocurrir a cualquier temperatura durante un período de tiempo suficientemente largo. (El helado viejo puede ser menos apetecible debido a la formación de grandes cristales de hielo ).
Una solución al problema de la desvitrificación es recalentar a velocidades extremadamente altas. Las frecuencias del horno de microondas (2450 MegaHertz ) no se pueden usar para este propósito porque las microondas producen un calentamiento desigual que conduce a la desnaturalización de la cabeza de algunas partes del tejido, mientras que otras partes aún están demasiado frías y son vulnerables al crecimiento de hielo. Pero las ondas electromagnéticas en el rango de 300 a 1000 megahercios pueden calentar de manera más uniforme que las frecuencias de microondas. Las propiedades dieléctricas de los crioprotectores afectan la uniformidad del calentamiento electromagnético. A las frecuencias adecuadas, un campo eléctrico cambiante puede hacer girar moléculas polares en un sólido vítreo, lo que da como resultado ondas reticulares que afectan la conductividad térmica . A baja temperatura un modelo Debyerepresenta con mayor precisión la capacidad calorífica predicha en función de la temperatura. La fuga térmica puede ocurrir si algunas regiones se calientan más rápidamente que otras, y el calentamiento reduce la conductividad térmica y la difusividad térmica. El propilenglicol se puede calentar en un campo dieléctrico de 434 megahercios con mayor uniformidad que el 2,3-butanodiol [ FÍSICA EN MEDICINA Y BIOLOGÍA; Robinson, parlamentario; 47(13):2311-2325 (2002) ].
En su innovadora vitrificación de 50 000 células de embriones de Drosophila (embriones ya diferenciados en tejidos y órganos, incluidos músculos y nervios) con etilenglicol, Peter Mazur descubrió que las tasas de calentamiento de 100 000 ºC por minuto eran esenciales para prevenir la desvitrificación. Reducir las tasas de calentamiento a 2000ºC por minuto redujo la supervivencia del 12% al 0% [ SCIENCE; Mazur,P; 258:1932-1935 (1992) ].
 |
Una segunda forma de prevenir la desvitrificación es el uso de antinucleares, como el alcohol polivinílico. Una tercera forma sería usar mezclas crioprotectoras que estén tan concentradas que nunca se pueda formar hielo. La formulación de crioprotector/bloqueador de hielo de 2004 de 21st Century Medicine puede evitar la desvitrificación en un volumen de 10 ml con tasas de calentamiento tan bajas como 0,4 °C por minuto [CRYOBIOLOGY 48:157-178 (2004)].
Una mezcla de vitrificación que no esté lo suficientemente concentrada para resistir la desvitrificación en estado líquido será metaestable , lo que significa que se desvitrificará si no se enfría lo suficientemente rápido hasta un estado sólido o si no se calienta lo suficientemente rápido. En una muestra que se desvitrifica porque se enfría más lentamente que su velocidad de enfriamiento crítica (la velocidad de enfriamiento mínima para evitar la desvitrificación), el agua se separará de la mezcla de vitrificación en forma de hielo. La fracción descongelada será, por lo tanto, una mezcla de vitrificación más concentrada, con una T g más alta y una velocidad de enfriamiento crítica más baja. La mayor T g se llama T g '. Si un paciente de criónica tiene una perfusión deficiente, la concentración de solución de vitrificación en los tejidos se reducirá, lo que elevará la tasa crítica de enfriamiento y aumentará la probabilidad de desvitrificación. Si se produce desvitrificación en un paciente criónico, el resultado será hielo en algunas áreas y una fracción descongelada concentrada en otras áreas que podría vitrificar a una T g ' tan alta como −110 ºC en lugar de la T g habitual de −123 ºC esperada para la solución de vitrificación (M22 para Alcor o CI−VM−1 para el Instituto Cryonics). El enfriamiento lento debe comenzar por encima de T g ' en lugar de por encima de T g si el fracturamiento se va a reducir bajo tales condiciones. [Consulte la siguiente sección para obtener más detalles sobre la fracturación. Para una discusión más detallada de T g ', consulte Algunas propiedades del vidrio .]
El problema de la desvitrificación surge debido al deseo de maximizar la viabilidad. Todos los agentes crioprotectores son tóxicos, unos más que otros. La vitrificación se puede lograr usando una pequeña cantidad de crioprotector y enfriando lo suficientemente rápido para evitar la nucleación. Sin embargo, si la toxicidad de los crioprotectores no fuera una preocupación y los crioprotectores más tóxicos se usaran en altas concentraciones, no habría desvitrificación a ninguna velocidad de enfriamiento.
IX. FRACTURA DE SUSTANCIAS VITRIFICADAS
Cerca de T g , se recomiendan velocidades de enfriamiento más lentas para evitar la fractura de la superficie, lo que se puede hacer sin mucho riesgo de cristalización debido a la alta viscosidad a baja temperatura. Puede encontrarse una descripción de los problemas físicos en la vitrificación de grandes sistemas biológicos en CRYOBIOLOGY 27(5):492-510 (1990) . El propilenglicol, que tiene una T g 10-20 ºC superior a la del glicerol, es el crioprotector descrito en este artículo. Cuanto más baja es la temperatura por debajo de Tg a la que se produce la fractura, más extensa es la fractura y más finamente divididas son las fracturas.
El enfriamiento rápido provoca más contracción en las partes externas que en las internas de un gran objeto biológico vitrificado, aunque literalmente hay un continuo de temperatura y contracción desde la superficie exterior hasta el centro. Los metales se pueden enfriar a una velocidad lo suficientemente lenta como para que no se acumulen tensiones térmicas y el metal se puede enfriar a cualquier temperatura sin agrietarse. Pero los metales se mantienen unidos por enlaces covalentes, que son mucho más fuertes que los enlaces de hidrógeno que unen los materiales biológicos vitrificados. Además, los metales son mucho mejores conductores del calor que los materiales biológicos vitrificados, lo que significa que la ecualización térmica de la temperatura puede ocurrir mucho más rápidamente en los metales. Sin embargo,T g [ANALES DE INGENIERÍA BIOMÉDICA; Rabin,Y; 33(9):1213-1228 (2005)].
En teoría, debería ser posible enfriar a los pacientes criónicos a la temperatura del nitrógeno líquido con la suficiente lentitud para que no se acumule tensión térmica y no se produzcan grietas. En la práctica, esto podría llevar semanas o meses. Los objetos del tamaño de una cabeza humana no pueden llevarse fácilmente a más de 20 ºC por debajo de la T g sin que se produzcan grietas importantes. Entonces, por razones prácticas, el enfriamiento se realiza en cuestión de días para minimizar el agrietamiento.
El "almacenamiento a temperatura intermedia (ITS)" se basa en la idea de que al almacenar justo por debajo de T g (−130 ºC), el agrietamiento se reduce considerablemente. Los segmentos de la arteria carótida de conejo se vitrificaron con éxito y se recalentaron con viabilidad mediante la optimización de las tasas de enfriamiento y calentamiento, el almacenamiento cerca de -131 °C o -132 °C y el examen del tejido vitrificado en busca de fracturas con un crioacroscopio [ TECNOLOGÍA DE PRESERVACIÓN DE CÉLULAS; Baicu,S; 4(4):236-244 (2006) ].
Desafortunadamente, el almacenamiento a -130 ºC cuesta aproximadamente el doble que el almacenamiento a -196 ºC (temperatura del nitrógeno líquido) debido a los mayores requisitos de espacio y al mayor nitrógeno líquido necesario para enfriar ese espacio. Incluso ITS no puede eliminar por completo el agrietamiento, porque la perfusión incompleta de los pacientes con criónica da como resultado la formación de hielo localizada y áreas localizadas de Tg elevada ( Tg ' ).
Aunque en el rango de ITS −135ºC a −145ºC se reduciría el agrietamiento debido al estrés térmico, estas temperaturas pueden no ser lo suficientemente frías para proteger a los pacientes de criónica de la degradación molecular durante los tiempos de almacenamiento durante décadas o siglos. (Consulte Viscosidad y transición vítrea). ITS también puede ser más vulnerable al daño por radiación que la temperatura del nitrógeno líquido. (Ver daño por radiación a temperatura criogénica )
[Para obtener más información sobre las tasas de enfriamiento en criónica, consulte Parámetros físicos de enfriamiento en criónica ].

