CONTENIDOS: ENLACES A SECCIONES POR TEMA
- ANTECEDENTES
- DIFUSIÓN DE LÍQUIDOS CORPORALES
- VISCOSIDAD Y TURBULENCIA
- LAVADO Y REEMPLAZO DE SANGRE
- DIFUSIÓN DE CRIOPROTECTORES
- PERFUSIÓN CRIOPROTECTORA
- PERFUSIÓN DE CABEZA
- LA BARRERA SANGRE-CEREBRO
- EDEMA EN CRIONICS
I. ANTECEDENTES
La preparación de un paciente de criónica para el crioalmacenamiento puede involucrar tres etapas distintas de alteración de los fluidos corporales:
(1) enfriamiento del paciente/soporte cardiopulmonar
(2) lavado/reemplazo de sangre para transporte de pacientes
(3) perfusión crioprotectora
Durante el enfriamiento/apoyo cardiopulmonar del paciente, un equipo de respuesta de emergencia de criónica o personal de atención médica puede inyectar una serie de medicamentos para minimizar la lesión isquémica y facilitar la crioconservación. El primero y más importante de estos medicamentos sería la heparina , para evitar la coagulación de la sangre. (Para obtener más detalles sobre el proceso de enfriamiento inicial, consulte Preparación para emergencias para un grupo local de criónica ).
Una vez que el paciente se enfría, la sangre se puede lavar y reemplazar con una solución destinada a mantener vivos los órganos/tejidos mientras se transporta al paciente a una instalación de criónica. En el centro de criónica, la solución de conservación de órganos/tejidos se reemplaza por la solución de criopreservación destinada a evitar la formación de hielo cuando el paciente se enfría aún más a temperaturas de −120 ºC (temperatura de transición vítrea) o −196 ºC (temperatura de nitrógeno líquido) para almacenamiento a largo plazo .
Tanto para la conservación de órganos/tejidos como para la crioprotección, es necesario reemplazar el contenido de fluidos de los vasos sanguíneos y las células de los tejidos con otros fluidos. El proceso de inyección y circulación de fluidos a través de los vasos sanguíneos se denomina perfusión . El proceso pasivo por el cual los fluidos entran y salen tanto de los vasos sanguíneos como de las células se llama difusión .
II. DIFUSIÓN DE LÍQUIDOS CORPORALES
 |
Los fluidos corporales se pueden describir como solutos disueltos en un solvente , donde el solvente es agua y los solutos son sustancias como cloruro de sodio (NaCl, sal de mesa), glucosa o proteína. Tanto las moléculas de agua como las de soluto tienden a moverse aleatoriamente en un fluido con energía y velocidad que es directamente proporcional a la temperatura. Cuando hay una diferencia en la concentración entre las moléculas de agua o soluto en un área del compartimiento de fluidos en comparación con el resto del compartimiento, el movimiento aleatorio de las moléculas eventualmente dará como resultado una distribución uniforme de todos los tipos de moléculas en todo el compartimiento. En termodinámica, esto se denomina disminución de la energía potencial (energía libre de Gibbs, no energía térmica) debido a un aumento de la entropía a temperatura constante, lo que conduce al equilibrio.
El movimiento de moléculas de un área de alta concentración a un área de baja concentración se llama difusión . La tasa de difusión ( J ) se puede cuantificar mediante la ley de difusión de Fick :
dc
J = − DA ----
dx
J = velocidad de difusión (moles/tiempo)
D = Coeficiente de difusión
A = Área a través de la cual se produce la difusión
dc/dx = gradiente de concentración (diferencia de concentración instantánea dividida por la distancia instantánea)
La primera ley de Fick establece que la velocidad de difusión a lo largo de un gradiente de concentración es proporcional a la magnitud instantánea del gradiente de concentración (que cambia a medida que avanza la difusión). Para el movimiento de moléculas de una región de mayor concentración a una región de menor concentración, dc/dx será negativo, por lo que multiplicar por −DA da un valor positivo a J. El coeficiente de difusión es mayor para temperaturas más altas y para moléculas más pequeñas.
La difusión puede ocurrir no solo dentro de un compartimento de fluidos, sino también a través de las particiones que separan los compartimentos de fluidos. Las particiones relevantes para los animales son las membranas celulares y las paredes capilares. Las membranas celulares son bicapas lipídicas que permiten la libre difusión de sustancias solubles en lípidos como oxígeno, nitrógeno, dióxido de carbono y alcohol, mientras bloquean el movimiento de iones y moléculas polares. Pero las membranas celulares también contienen canales hechos de proteína. Los canales de proteínas para el agua permiten una difusión muy rápida del agua a través de las membranas. Los canales de proteínas para potasio (K + ), sodio (Na + ) y otros iones permiten una difusión más restringida a través de las membranas celulares. También hay difusión facilitada (transporte activo) de muchos tipos de moléculas a través de las membranas.
Para un adulto normal de 70 kilogramos (154 libras), el líquido corporal total es aproximadamente el 60% del peso corporal. Casi todo este líquido se puede describir como extracelular o intracelular (excluyendo solo el líquido cefalorraquídeo, el líquido sinovial y algunos otros pequeños compartimentos de líquido). El líquido extracelular se puede subdividir en plasma (parte no celular de la sangre) y líquido intersticial (líquido entre las células que no está en los vasos sanguíneos). Las membranas celulares separan el líquido intracelular del líquido extracelular, mientras que las paredes capilares separan el plasma del líquido intersticial. Los porcentajes relativos de estos fluidos se pueden resumir como:
Líquido intracelular 67 %
Líquido extracelular Líquido
intersticial 26 %
Plasma 7 %
Tenga en cuenta que el volumen de sangre incluye tanto el plasma como las células sanguíneas, de modo que al agregar el volumen de fluido intracelular de las células sanguíneas al volumen de plasma, la sangre representa el 12% del fluido corporal total.
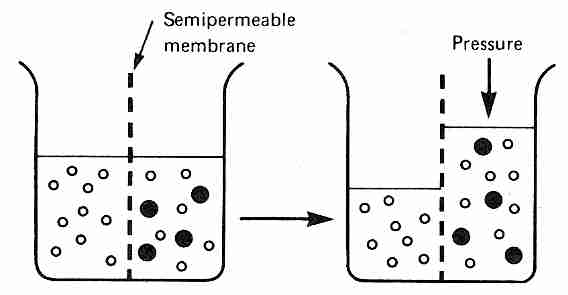 |
La ósmosis se refiere a la difusión de agua (disolvente) a través de una membrana que es semipermeable , es decir, permeable al agua, pero no a todos los solutos de la solución. Si se agregan solutos impermeables a la membrana a un lado de la membrana, pero no al otro lado, el agua estará menos concentrada en el lado del soluto de la membrana. Este gradiente de concentración hará que el agua se difunda a través de la membrana semipermeable hacia el lado de los solutos, a menos que se aplique presión para evitar la difusión del agua. La cantidad de presión requerida para evitar cualquier difusión de agua a través de la membrana semipermeable se denomina presión osmótica de la solución con respecto a la membrana.
La presión osmótica (como la disminución de la presión de vapor y la depresión del punto de congelación) es una propiedad coligativa , lo que significa que la cantidad de partículas en solución es más importante que el tipo de partículas. Una molécula de albúmina (peso molecular 70 000) contribuye tanto a la presión osmótica como una molécula de glucosa o un ion de sodio. En el equilibrio, todas las moléculas en una solución han alcanzado la misma energía cinética promedio, lo que significa que las moléculas con una masa más pequeña tienen una velocidad promedio más alta. Por lo tanto, una solución un molar de NaCl dará como resultado el doble de la presión osmótica que una solución un molar de solución de glucosa, porque los iones Na + y Cl − ejercen presión osmótica como partículas independientes.
Las concentraciones de soluto se expresan generalmente en términos de molaridad (moles de soluto por litro de solución). La osmolaridad de una solución es el producto de la molaridad del soluto y el número de partículas disueltas producidas por el soluto. Una solución de un molar (1,0 M, un mol por litro) de CaCl 2 es una solución de tres osmolares (tres osmoles por litro) debido al ion Ca 2+ más los dos iones Cl − producidos cuando se agrega CaCl 2 al agua. Osmolaridad , el número de partículas de soluto por litro ha sido reemplazado en la práctica por la osmolalidad., el número de partículas de soluto por kilogramo . (Para soluciones diluidas, los valores de los dos son muy parecidos). Para describir las concentraciones de soluto en los fluidos corporales, es más conveniente usar milésimas de osmoles, mili-osmoles ( mOsm ). La osmolalidad total de solutos del líquido intracelular, el líquido intersticial o el plasma es de aproximadamente 300 mOsm/kgH 2 O. Aproximadamente la mitad de la osmolalidad del líquido intracelular se debe a los iones de potasio y los aniones asociados, mientras que aproximadamente el 80 % de la osmolalidad del líquido intersticial y el plasma se debe a los iones de potasio y los aniones asociados. debido a los iones de sodio y cloruro.
Como se indicó anteriormente, tanto la presión osmótica como la depresión del punto de congelación son propiedades coligativas. Todas las propiedades coligativas son convertibles. Un osmol de cualquier soluto bajará el punto de congelación del agua en 1.858ºC. Por esta razón, una solución de NaCl al 0,9% es 0,154 molar o alrededor de 308 mOsm/kgH 2 O, y bajará el punto de congelación del agua en alrededor de 0,572ºC.
La osmolalidad de una solución es una cantidad absoluta que se puede calcular o medir. la tonicidadde una solución es un concepto relativo que se asocia con la presión osmótica y la capacidad de los solutos para atravesar una membrana semipermeable. Por lo tanto, la tonicidad de una solución es relativa a los solutos particulares y a una membrana particular, específicamente en relación con si los solutos cruzan o no la membrana. Las membranas celulares son las membranas de mayor importancia biológica. Que una célula se encoja o se hinche en una solución está determinado por la tonicidad de la solución, no necesariamente por la osmolalidad. Solo cuando todos los solutos no cruzan la membrana semipermeable, la osmolalidad proporciona una medida cuantitativa de la tonicidad. Es común hablar como si la tonicidad y la osmolalidad fueran equivalentes porque los solutos de los fluidos corporales suelen ser impermeables. Cada mOsm/kgH 2El O del líquido contribuye con unos 19 mmHg a la presión osmótica.
Se dice que una solución es isotónica si las células no se contraen ni se hinchan en esa solución. Tanto NaCl al 0,9% (solución salina fisiológica) como glucosa al 5% (en ausencia de insulina) son soluciones isotónicas (aproximadamente 300 mOsm/kgH 2 O de soluto impermeable). (En presencia de insulina, la glucosa al 5% es una solución hipotónica porque la insulina hace que la glucosa atraviese las membranas celulares). Las soluciones hipertónicas hacen que las células se encojan a medida que el agua sale de las células hacia el soluto, mientras que las células colocadas en soluciones hipotónicas hacen que las células se encojan. se hinchan a medida que el agua de la solución se precipita hacia las células.
Un cálculo exacto de la osmolalidad del plasma da 308 mOsm/kgH 2 O, pero la depresión del punto de congelación del plasma (−0,54 ºC) indica una osmolalidad de 286 mOsm/kgH 2 O. La interacción de los iones reduce la osmolalidad efectiva. Los iones de sodio (Na + ) y los aniones que lo acompañan (principalmente Cl − y HCO 3 − ) explican la osmolalidad plasmática excepto unos 20 mOsm/kgH 2 O. La concentración de sodio en plasma normalmente está controlada por el contenido de agua en plasma (sed, etc.) [ BMJ; ReynoldsRM; 332:702-705 (2006) ]. La concentración sérica normal de Na + está en el rango de 135 a 145 milimoles por litro, siendo 135 mmol/L el umbral para hiponatremia _ La concentración de sodio intracelular suele ser de unos 20 mmol/L, aproximadamente una séptima parte de la concentración extracelular. La glucosa y la urea representan aproximadamente 5 mOsm/kgH 2 O. La osmolalidad del plasma generalmente se aproxima duplicando los iones de sodio (para incluir todos los aniones asociados), agregando esto a las moléculas de glucosa y urea e ignorando todas las demás moléculas como insignificantes. La proteína contribuye a menos del 1% de la osmolalidad del plasma. (Las células contienen aproximadamente cuatro veces la concentración de proteínas que contiene el plasma).
Aunque el etanol aumenta la osmolalidad de una solución, no aumenta la tonicidad porque (como el agua) el etanol atraviesa las membranas celulares. Un estado hiperosmolar clínico sin hipertonicidad puede ocurrir con un aumento en el etanol extracelular (que se difunde en las células) [ MINERVA ANESTESIOLOGICA; Offenstadt,G; 72(6):353-356 (2006) ]. El glicerol también atraviesa fácilmente las membranas celulares, pero lo hace miles de veces más lentamente que el agua, lo que significa que el glicerol es "transitoriamente hipertónico" (solo isotónico en equilibrio). El etilenglicol atraviesa las membranas de los glóbulos rojos unas seis veces más rápido que el glicerol (y las membranas de los espermatozoides cuatro veces más rápido que el glicerol). Realmente. incluso para el agua hay un tiempo finito para la conductividad hidráulicaa través de las membranas celulares.
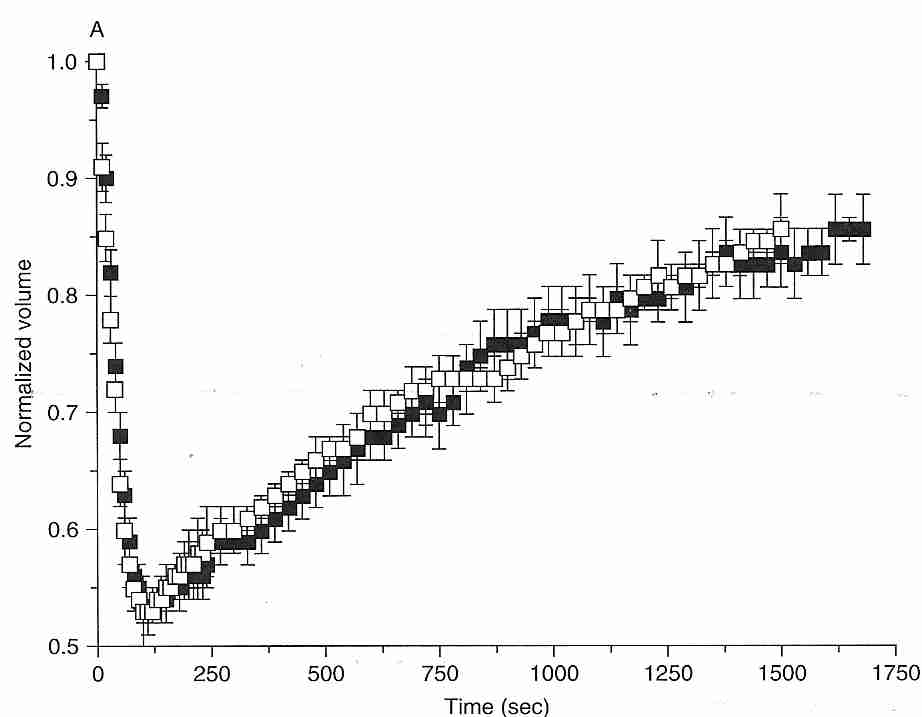 |
Las células colocadas en una solución "transitoriamente hipertónica" (que contiene solutos que atraviesan lentamente una membrana) inicialmente se encogerán rápidamente a medida que el agua sale de la célula, y gradualmente se volverán a hinchar a medida que el soluto ingresa lentamente a la célula (el " ciclo de contracción/hinchamiento "). Como se muestra en el diagrama de ovocitos de ratón a 10ºC, el agua sale de la célula en los primeros 100 segundos, mientras que el etilenglicol 1,5 molar (cuadrados negros) o el DMSO (dimetilsulfóxido, cuadrados blancos) tardan 1.750 segundos en restaurar el volumen al 85 % del volumen celular original [CRIOBIOLOGIA; Paynter,SJ; 38:169-176 (1999)]. Incluso si una célula no revienta o colapsa debido a un desequilibrio osmótico, un cambio repentino en el equilibrio osmótico puede dañar las células. No obstante, las células son algo tolerantes a las soluciones hipotónicas. Granulocitosson particularmente sensibles al estrés osmótico, pero la supervivencia de los granulocitos no se ve afectada significativamente por las soluciones hipertónicas hasta que la osmolaridad de los solutos impermeables se aproxima al doble de los valores fisiológicos (alrededor de 600 mOsm/kgH 2 O) [ AMERICAN JOURNAL OF PHYSIOLOGY; Armitage WJ; 247 (5 parte 1): C373-381 (1984) ].
Las células PC3 casi no muestran disminución de la supervivencia tras la exposición a 5.000 mOsm/kgH 2 O NaCl durante 60 minutos a 0ºC, y muestran una supervivencia celular de casi el 85% tras la rehidratación. Casi el 85% sobrevive a 9.000 mOsm/kgH 2 O NaCl durante 60 minutos a 0ºC, pero menos del 20% sobrevive a la rehidratación. Pero aunque a 23ºC la mayoría de las células sobreviven a la exposición a 5000 mOsm/kgH 2 O NaCl durante 60 minutos, sólo alrededor de un tercio de las células sobrevive a la rehidratación. A 23ºC y 9.000 mOsm/kgH 2 O NaCl sólo la mitad de las células sobreviven 60 minutos y ninguna sobrevive a la rehidratación, lo que indica el efecto protector de la baja temperatura contra el estrés osmótico. El flujo de agua a 23ºC fue el mismo para 9.000 mOsm/kgH 2 O que para 5.000 mOsm/kgH 2O, y la supervivencia de las células hipertónicas no se vio afectada por la tasa de aumento de la concentración [CRIOBIOLOGÍA; Zawlodzka,S; 50(1):58-70 (2005)].
El estrés hiperosmótico daña no solo las membranas celulares, sino también el citoesqueleto, inhibe la replicación y traducción del ADN, despolariza las mitocondrias y daña el ADN y las proteínas. Las proteínas de choque térmico y los osmolitos orgánicos (como sorbitol y taurina) se sintetizan como protección contra el estrés hiperosmótico. Las células altamente proliferativas (como PC3) sufren estrés osmótico más que las células menos proliferativas porque estas últimas pueden movilizar las defensas celulares más fácilmente debido a que menos células experimentan mitosis en el momento del estrés osmótico [REVISIONES FISIOLÓGICAS; Burg, MB; 87(4):1441-1474 (2007)].
Una distinción importante para recordar al reemplazar los fluidos corporales es la distinción entre dos tipos de inflamación ( edema ): inflamación celular e inflamación tisular . La inflamación celular ocurre cuando hay una menor concentración de solutos impermeables a la membrana disueltos fuera de las células que dentro de las células. Para evitar el encogimiento o la hinchazón de una célula, debe haber un equilibrio osmótico.de moléculas e iones entre los líquidos fuera de la célula y dentro de la célula. Las paredes capilares son membranas semipermeables que son permeables a la mayoría de las moléculas pequeñas e iones que no atravesarán las membranas celulares, pero son impermeables a las moléculas grandes denominadas coloides (proteínas). La presión osmótica coloidal sobre las paredes capilares debida a las proteínas se denomina presión oncótica . Para el plasma humano normal, la presión oncótica es de aproximadamente 28 mmHg, 9 mmHg de los cuales se deben al efecto Donnan , que hace que los aniones pequeños se difundan más fácilmente que los cationes pequeños porque los cationes pequeños son atraídos (pero no unidos) al aniónico. proteinas Alrededor del 60% de la proteína plasmática total es albúmina (30 a 50 gramos por litro), siendo el resto globulinas. Pero la albúmina representa el 75-80% de la presión oncótica intravascular total. La inflamación de los tejidos ocurre cuando los líquidos se filtran de los vasos sanguíneos hacia el espacio intersticial (el espacio entre las células de los tejidos). La lesión de los vasos sanguíneos puede provocar la inflamación de los tejidos, pero la inflamación de los tejidos también puede deberse a la fuga de agua de los vasos cuando no hay nada (como la albúmina) que impida la fuga.
Ambas formas de edema (hinchazón de células y tejidos) pueden impedir considerablemente la perfusión y, con frecuencia, es un problema en pacientes criónicos que han sufrido isquemia u otras formas de daño en los vasos sanguíneos. Mantener el equilibrio osmótico de los fluidos fuera y dentro de las células es tan importante como mantener el equilibrio oncótico , es decir, el equilibrio de los fluidos dentro y fuera de los vasos sanguíneos.
Gran parte de la isotonicidad de los líquidos intracelular y extracelular es mantenida por la bomba de sodio en las membranas celulares, que exporta 3 iones de sodio por cada 2 iones de potasio importados a las células. Las proteínas de las células son más osmóticamente activas que las proteínas del líquido intersticial. Debido al efecto Donnan, se requiere la bomba de sodio para evitar la inflamación de las células. Cuando la isquemia priva de energía a la bomba de sodio, las células se hinchan debido al exceso de sodio intracelular (porque el sodio atrae más agua que el potasio), lo que produce edema. La inflamación también puede causar hinchazón celular debido al aumento de la permeabilidad de la membrana al sodio y otros iones. El edema intersticial puede ocurrir cuando la isquemia o la inflamación aumentan la permeabilidad capilar y provocan la fuga de solutos plasmáticos más grandes hacia el espacio intersticial.
[Para más detalles sobre la bomba de sodio ver POTENCIAL DE MEMBRANA, RELACIONES K/Na Y VIABILIDAD ]
Cerca del hipotálamo del cerebro hay osmorreceptores (fuera de la barrera hematoencefálica) que controlan la osmolalidad de la sangre, que normalmente está en el rango de 280-295 mOsm/kgH 2 O. Un aumento del 2% en la presión osmótica del plasma puede provocar sed. Un aumento en la osmolalidad del plasma puede indicar una pérdida excesiva de volumen de sangre. Para compensar, la hipófisis posterior (neurohipófisis) secreta la hormona 8-arginina vasopresina ( AVP ), que son dos hormonas en una, de ahí los dos nombres vasopresina y hormona antidiurética . La acción de AVP sobre los receptores V 1 de los vasos sanguíneos provoca vasoconstricción (vasopresina). Acción AVP en el V 2receptores del riñón provoca retención de agua (hormona antidiurética). La deficiencia en la secreción de AVP puede provocar diabetes incipidus , llamada así porque la orina excretada en exceso no tiene sabor (incipid), en contraste con la orina dulce (cargada de glucosa) de la diabetes mellitus. El cortisol se opone a la acción de AVP en la excreción, lo que lleva a la deshidratación y la micción excesiva de líquido. La reducción del flujo sanguíneo al riñón estimula la liberación de renina, que cataliza la producción de angiotensina . Al igual que la AVP, la angiotensina provoca vasoconstricción y retención de líquidos en los riñones.
Las ratas sometidas a isquemia focal experimental han mostrado una reducción del edema cuando se las trata con un antagonista de AVP [ STROKE; Shuaib,A; 33(12):3033-3037 (2002) ]. Se ha demostrado que la solución salina hipertónica (7,5 %) reduce a la mitad los niveles de AVP en plasma en ratas experimentales, mientras que el manitol (20 %) no tuvo ningún efecto [ JOURNAL OF APPLIED FISIOLOGY; Chang,Y; 100(5):1445-1451 (2006) ]. Los aumentos en la osmolaridad plasmática debido a la urea o el glicerol no tienen efecto sobre los niveles plasmáticos de AVP [ JOURNAL OF THE AMERICAN SOCIETY OF NEPHROLOGY; Verbalis,JG; 18(12):3056-3059 (2007)]. El efecto de la solución salina hipertónica sobre el edema osmótico debido a AVP en un paciente con criónica probablemente sería insignificante debido a la liberación y el transporte de hormonas insignificantes. Por lo tanto, algunas de las ventajas de la solución salina hipertónica sobre el manitol observadas en los ensayos clínicos no ocurrirían en los casos de criónica.
| Variación de las fuerzas de Starling por un capilar (presión arterial y presión oncótica) |
|---|
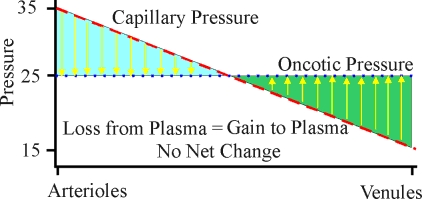 |
El movimiento neto de líquido a través de las membranas capilares debido a las fuerzas hidrostáticas y oncóticas se puede describir mediante la ecuación de Starling.. La ecuación de Starling proporciona un flujo de líquido neto a través de las paredes capilares como resultado del exceso de presión hidrostática capilar sobre la presión hidrostática del líquido intersticial y la presión oncótica capilar sobre la presión oncótica del líquido intersticial, modificada por la permeabilidad al agua del capilar. Para una persona normal (animada), la presión hidrostática (presión sanguínea) en el extremo arterial de un capilar es de unos 35 mmHg. La presión hidrostática cae de forma lineal a lo largo del capilar hasta que es de unos 15 mmHg en el extremo de la vénula. La presión oncótica neta dentro del capilar es de aproximadamente 25 mmHg en toda la longitud del capilar. Por lo tanto, para la primera mitad del capilar hay una pérdida neta de líquido hacia el espacio intersticial hasta que la presión hidrostática cae a 25 mmHg. Para la segunda mitad del capilar hay una ganancia neta de líquido en el capilar desde el espacio intersticial. El flujo de líquido hacia el espacio intersticial en la primera mitad del capilar está asociado con el suministro de oxígeno y nutrientes a los tejidos, mientras que el flujo de líquido desde el espacio intersticial hacia la segunda mitad del capilar está asociado con la eliminación de dióxido de carbono y otros productos de desecho.
En realidad, hay un flujo neto diminuto (diminuto en relación con la difusión total de un lado a otro a través de la pared capilar) de líquido desde los capilares hasta el líquido intersticial, que es devuelto a los vasos sanguíneos por el sistema linfático. Los vasos linfáticos contienen válvulas unidireccionales y dependen del movimiento del músculo esquelético para impulsar el líquido linfático. El bloqueo infeccioso del flujo linfático puede producir edema. Una persona sentada durante largos periodos (como durante un viaje largo) o parada mucho tiempo sin moverse puede experimentar tobillos hinchados debido a la falta de actividad muscular. Los tobillos hinchados también son un síntoma frecuente del edema resultante de la insuficiencia cardíaca congestiva. La presión venosa se eleva por la capacidad reducida del corazón para extraer sangre del sistema venoso, mientras que la vasoconstricción puede compensar mejor para mantener la presión en el lado arterial.
Las fuerzas de Starling son diferentes para la barrera hematoencefálica (BBB) que para otros capilares del cuerpo debido a la permeabilidad reducida al agua (conductividad hidráulica más baja) y la permeabilidad muy reducida a los electrolitos. La presión osmótica del plasma y el líquido intersticial se convierten efectivamente en presiones oncóticas.
tercero VISCOSIDAD Y TURBULENCIA
Se hace una distinción crítica en mecánica de fluidos entre flujo laminar y flujo turbulento en una tubería. Para el flujo laminar, los elementos de un líquido siguen líneas de corriente rectas, donde la velocidad de una línea de corriente es más alta en el centro del recipiente y más lenta cerca de las paredes. Flujo turbulentose caracteriza por remolinos y movimientos caóticos que pueden aumentar sustancialmente la resistencia y reducir el caudal. El número de Reynolds es una cantidad adimensional determinada empíricamente que se utiliza para predecir si el flujo será laminar o turbulento, siendo 2000 el límite inferior aproximado para el flujo turbulento. La turbulencia localizada transitoria se puede inducir en un número de Reynolds tan bajo como 1600, pero la turbulencia temporal permanente se forma por encima de 2040 [ CIENCIA; Eckhart,B; 333:165 (2011) ].
El flujo turbulento podría ser potencialmente un problema en la criónica si reduce la tasa de perfusión o aumenta la cantidad de presión requerida para mantener una tasa de perfusión. Sin embargo, es dudoso que el flujo turbulento juegue alguna vez un papel en la perfusión criónica. Incluso para un sujeto a temperatura corporal (37ºC) , los números de Reynolds superiores a 2000 solo se ven en los vasos sanguíneos más grandes: la aorta y la vena cava .
La fórmula para el número de Reynolds es:
ρ v D
Re = ------
µ
ρ = densidad del fluido (rho)
v = velocidad del fluido
D = diámetro del recipiente
µ = viscosidad del fluido
El hecho de que el diámetro (D) esté en el numerador indica que solo los vasos de gran diámetro tienen un número de Reynolds alto. La velocidad (v), también en el numerador, es más alta en la aorta y las arterias. Pero el uso de crioprotectores y el aumento de la viscosidad (µ) con la disminución de la temperatura garantizan esencialmente que no se producirá un flujo turbulento en un paciente de criónica.
Más seria para la criónica es la Ley de Hagen-Poisseuille , que describe la relación entre el caudal y la presión de conducción:
presión X ( radio ) 4
Caudal = ----------------- -----
longitud X viscosidad
Por lo general, en criónica, el caudal será de uno o dos litros por minuto cuando la presión sea de alrededor de 80 mmHg. Pero debido a que el caudal varía inversamente con la viscosidad y varía directamente con la presión, se debe aumentar la presión para mantener los caudales cuando la viscosidad del crioprotector aumenta al disminuir la temperatura. Esto plantea un problema grave porque los vasos sanguíneos se vuelven más frágiles al bajar la temperatura. Si los vasos sanguíneos revientan, la perfusión puede fallar.
A 20ºC el glicerol es un 25% más denso (ρ=rho, en el numerador) que el agua. Pero el papel de la viscosidad es mucho más dramático, con una alta viscosidad en el denominador que reduce considerablemente el número de Reynolds. La viscosidad del agua se duplica aproximadamente de 37ºC a 10ºC, pero la viscosidad del glicerol aumenta por un factor de diez (aproximadamente 4 Poise a 40 Poise). A 37ºC el glicerol es casi 600 veces más viscoso que el agua, pero a 10ºC es unas 2600 veces más viscoso.
Aunque la turbulencia no es una preocupación en la criónica, el aumento de la viscosidad del crioprotector con la disminución de la temperatura ciertamente lo es. Afortunadamente, las mezclas de vitrificación más nuevas son menos viscosas que el glicerol.
La estrategia más habitual en criónica ha sido enfriar al paciente de 37ºC a 10ºC lo más rápido posible y perfundir con crioprotector a 10ºC. Bajar la temperatura corporal reduce considerablemente el metabolismo, disminuyendo así la cantidad de oxígeno y nutrientes necesarios para mantener vivos los tejidos. La toxicidad de los crioprotectores disminuye a medida que desciende la temperatura. Pero el aumento muy dramático, más que exponencial, de la viscosidad del crioprotector con la disminución de la temperatura plantea un problema importante para una perfusión eficaz. Cuando se usa perfusión de circuito abierto, puede ser preferible una temperatura más alta porque la oportunidad de tiempo de difusión en las células es muy limitada (alrededor de 2 horas, 1 hora para la cabeza, 1 hora para el cuerpo), aunque el daño isquémico es difícil de cuantificar.
Con la perfusión de circuito cerrado , los tiempos de perfusión son más largos, hasta 5 horas. Si se utiliza una buena solución portadora para el crioprotector, los tejidos pueden recibir los nutrientes adecuados. Esto, junto con la capacidad de transporte de oxígeno del agua a baja temperatura, puede limitar el daño isquémico y dar tiempo a que las células se carguen por completo con el crioprotector. Si el daño isquémico se puede prevenir con seguridad en la perfusión, los únicos aspectos críticos para la selección de la temperatura son los beneficios relativos de la toxicidad crioprotectora reducida a temperaturas más bajas frente al aumento del daño por frío. El hecho de que el aumento más que exponencial de la viscosidad con la disminución de la temperatura aumente el tiempo de perfusión no será problemático si se minimiza el riesgo de isquemia.
IV. LAVADO Y REEMPLAZO DE SANGRE
Por lo general, un paciente de criónica se desanima a una distancia considerable de una instalación de criónica y debe ser transportado antes de que se puedan perfundir los crioprotectores. La sangre podría lavarse y reemplazarse con una solución isotónica (es decir, osmóticamente igual a la solución salina), como la solución de Ringer . Luego se transporta al paciente a la instalación de criónica a temperatura de agua helada. Debe evitarse la congelación porque los cristales de hielo dañarían las células y los vasos sanguíneos hasta el punto de impedir la perfusión eficaz del crioprotector. La temperatura del hielo de agua no congelará los tejidos porque los tejidos son salados (la sal reduce el punto de congelación por debajo de 0ºC).
A medida que la temperatura corporal se acerca a los 10 ºC, la tasa metabólica se ralentiza mucho y ya no se necesita la capacidad de transporte de oxígeno de la hemoglobina sanguínea. El agua fría, de hecho, puede transportar suficiente oxígeno disuelto a bajas temperaturas. (El agua cercana a la temperatura de congelación puede contener casi tres veces más oxígeno disuelto que el agua cercana a la temperatura de ebullición. El oxígeno es unas cinco veces más soluble en agua que el nitrógeno). La tendencia de la sangre a aglutinarse y obstruir los vasos sanguíneos se convierte en un problema grave a bajas temperaturas. — por lo que la sangre debe reemplazarse si esto no causa otros problemas (como retraso y lesión por reperfusión ).
Sin embargo, reemplazar la sangre con una solución salina para el transporte del paciente no hace un buen trabajo para mantener la viabilidad del tejido o prevenir el edema y probablemente causaría una lesión por reperfusión. Por esta razón, se ha utilizado una solución de preservación de órganos como Viaspan® , en lugar de la solución de Ringer, para el transporte de criopacientes. La sangre no es simplemente una solución isotónica que transporta células sanguíneas. La sangre contiene albúmina, que atrae el agua y evita que el agua salga de los vasos sanguíneos y entre en los tejidos (mantiene el equilibrio oncótico). Los tejidos inflamados por el agua (tejidos edematosos) resisten la perfusión de crioprotectores. Uno de los ingredientes más importantes de Viaspan® para prevenir el edema es el hidroxietilalmidón ( HES), que atrae el agua de la misma manera que la albúmina atrae el agua, actuando como un agente oncótico al mantener el agua en los vasos sanguíneos. Viaspan® contiene lactobionato de potasio para ayudar a mantener el equilibrio osmótico. Debido a que HES es difícil de obtener y puede causar alteraciones en la microcirculación, el polietilenglicol (PEG) se ha utilizado en soluciones de preservación de órganos como reemplazo de HES con buenos resultados [ THE JOURNAL OF PHARMACOLOGY AND EXPERIMENTAL THERAPEUTICS; Faure, J; 302(3):861-870 (2002) y TRASPLANTE DE HÍGADO; Bessems,M; 11(11):1379-1388 (2005)].
Sin embargo, es posible que el mismo beneficio no se aplique a los pacientes con criónica debido a la prevalencia del daño endotelial debido a la isquemia. Los "agujeros" más grandes en la vasculatura pueden significar que se requiere una molécula de mayor peso molecular para el soporte oncótico. El peso molecular de HES es de aproximadamente 500 000, mientras que el peso molecular del PEG utilizado en soluciones de reemplazo de órganos es más como 20 000. La albúmina (que tiene un peso molecular de alrededor de 70 000) proporciona la mayor parte del apoyo oncótico en la fisiología normal. Un PEG con un peso molecular de 500.000 sería demasiado viscoso y formaría un gel. HES tiene la ventaja de ser lo suficientemente grande para proporcionar siempre apoyo oncótico mientras que es mucho menos viscoso que PEG de peso molecular equivalente.
Viaspan® (DuPont Merck Pharmaceuticals) contiene otros ingredientes para mantener la viabilidad de los tejidos, como glucosa, glutatión, etc. (la fórmula completa se puede encontrar en el sitio web de Viaspan® ). Viaspan® está aprobado por la FDA para la conservación del hígado, los riñones y el páncreas, pero se usa de forma no autorizada para trasplantes de corazón y pulmón. Viaspan® está siendo desafiado en el mercado para todas estas aplicaciones por la línea de soluciones de conservación Hypothermosol (Cryomedical Sciences, BioLife Technologies).
En lugar de usar estos costosos productos comerciales, Alcor y Suspended Animation, Inc. usan una solución de preservación desarrollada por Jerry Leaf y Mike Darwin llamada MHP-2.. MHP-2 se llama así porque es un perfundido (P) que contiene manitol (M) como agente osmótico extracelular y HEPES (H), un tampón para prevenir la acidosis que es eficaz a baja temperatura. MHP-2 también contiene ingredientes para mantener la viabilidad de los tejidos e hidroxietilalmidón como agente oncótico para prevenir el edema. El lactobionato penetra menos en las células que el manitol y, por lo tanto, puede mantener el equilibrio osmótico durante períodos de tiempo más prolongados, pero el manitol es mucho menos costoso. El manitol también tiene un efecto adicional en el cerebro. Debido a la estanqueidad única de las uniones de las células endoteliales de los capilares cerebrales ("barrera hematoencefálica"), poco manitol sale de los vasos sanguíneos para pasar al cerebro. Esto significa que el manitol puede actuar como un agente oncótico para el cerebro. Si la barrera hematoencefálica está intacta, el manitol succionará el agua del espacio extravascular. El cerebro es el único lugar donde el manitol puede hacer esto, y es por eso que el manitol es eficaz para inhibir el edema del cerebro, perosolo si no hay daño isquémico extenso a la barrera hematoencefálica. (El manitol tiene aún otro beneficio en el sentido de que elimina el radical hidroxilo [CHEM.-BIOL. INTERACTIONS 72:229-255 (1989)]).
(Para conocer la fórmula de MHP-2, consulte la Tabla II de CryoMsg 4474 o la Tabla VII de CryoMsg 2874 , que también contiene la fórmula de Viaspan en la Tabla V).
La perfusión inicial también puede contener otros ingredientes para ayudar a reducir el daño al paciente de criónica. Los anticoagulantes pueden reducir los problemas de coagulación y los antibióticos pueden reducir el daño bacteriano. Los efectos dañinos de la isquemia se pueden reducir con antioxidantes, antiacidificantes, un quelante de hierro y un bloqueador de los canales de calcio.
Tanto Alcor como Suspended Animation, Inc. utilizan un sistema de equipo de perfusión transportable por aire (ATP) que les permite realizar lavados de sangre en lugares remotos de cualquier instalación de criónica mediante el uso de equipos que se pueden transportar fácilmente en un avión. Hay un video de demostración de un ATP en YouTube.
[Para obtener más detalles sobre la solución de preservación de órganos, consulte SOLUCIÓN DE TRASPLANTE DE ÓRGANOS ]
V. DIFUSIÓN DE CRIOPROTECTORES
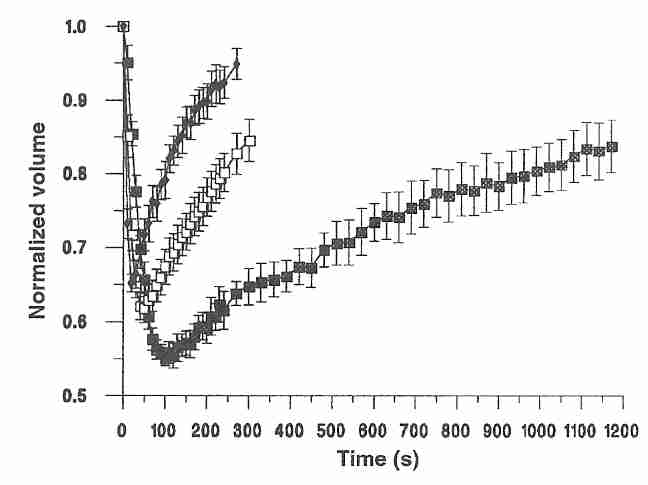 |
Los crioprotectores se utilizan en criónica para reducir el daño por congelación mediante la prevención de la formación de hielo (ver Vitrificación en criónica ). Las células son mucho más permeables al agua que a los crioprotectores. Las plaquetas y los granulocitos, por ejemplo, son 4000 veces más permeables al agua que al glicerol [ CRIOBIOLOGÍA; Armitage,WJ; 23(2):116-125 (1986) ]. Cuando una célula se expone a un crioprotector de alta potencia, la ósmosis hace que el agua salga rápidamente de las células, lo que hace que se encojan. Solo muy gradualmente el crioprotector cruza las membranas celulares para entrar en la célula (el " ciclo de contracción/hinchamiento ")."). Para células aisladas, el tiempo medio (tiempo para reducir a la mitad la diferencia entre una concentración dada de glicerol en un granulocito y la concentración máxima posible) es de 1,3 minutos [ EXPERIMENTAL HEMATOLOGY; Dooley, DC; 10(5):423-434 (1982) ) ], pero los tejidos y los órganos requerirían más tiempo porque sus células son menos accesibles. Sin embargo, incluso después del equilibrio, la concentración de glicerol dentro de los granulocitos neutrófilos nunca supera el 78 % de la concentración fuera de las células.
Como se muestra en el diagrama de ovocitos humanos maduros colocados en una solución de DMSO 1,5 molar, el ciclo de contracción/hinchamiento depende en gran medida de la temperatura, con una velocidad de recuperación más lenta y un mayor cambio de volumen a temperaturas más bajas [ REPRODUCCIÓN HUMANA; Paynter,SJ; 14(9):2338-2342 (1999) ]. Esto crea decisiones difíciles en la criónica, porque los crioprotectores son más tóxicos a temperaturas más altas.
La proliferación de células renales cultivadas disminuye linealmente con el aumento de la osmolalidad debido a la urea y el NaCl por encima de 300 mOsm/kgH 2 O, pero el efecto del glicerol agregado sobre el crecimiento celular es mucho menor [ AMERICAN JOURNAL OF PHYSIOLOGY; Michea,L; 278(2):F209-F218 (2000) ]. Las células renales que in vivo pueden tolerar osmolalidades de alrededor de 300 mOsm/kgH 2 O no sobreviven a más de 300 mOsm/kgH 2 O in vitro , posiblemente debido a una proliferación más rápida [REVISIONES FISIOLÓGICAS; Burg, MB; 87(4):1441-1474 (2007)].
Las células sujetas a altos niveles de crioprotectores pueden dañarse por estrés osmótico. Cuantificar el daño osmótico ha sido un desafío para los experimentadores que deben distinguir entre el daño electrolítico, la toxicidad de los crioprotectores, los efectos del volumen celular y el estrés osmótico. Con respecto a los dos últimos, el daño osmótico debido a la contracción celular puede distinguirse del daño osmótico como resultado de la velocidad a la que el crioprotector atraviesa la membrana celular, es decir, por la permeabilidad de la membrana al crioprotector. Los crioprotectores con permeabilidades más bajas pueden causar más estrés osmótico que los crioprotectores con alta permeabilidad.
|
Se han estudiado las permeabilidades de membrana de una variedad de no electrolitos (incluidos los crioprotectores) en varios tipos de células, incluidas las células sanguíneas humanas [ THE JOURNAL OF GENERAL FISIOLOGÍA; Naccaché, P; 62(6):714-736 (1973) ]. Los factores críticos que determinan la permeabilidad de la membrana son la solubilidad en lípidos de la sustancia (que aumenta la permeabilidad) y los enlaces de hidrógeno (que disminuyen la permeabilidad). En general, la permeabilidad disminuye a medida que aumenta el tamaño molecular de la sustancia. A diferencia de las células sanguíneas, el esperma humano es tres veces más permeable al glicerol que al DMSO [ BIOLOGÍA DE LA REPRODUCCIÓN; Gilmore,JA; 53(5):985-995 (1995)]. Tanto para las células sanguíneas como para los espermatozoides, la permeabilidad al etilenglicol es muy alta en comparación con otros crioprotectores comunes. Sin embargo, para los ovocitos humanos maduros, el glicol de propileno tiene la permeabilidad más alta y el glicol de etileno tiene la permeabilidad más baja de los crioprotectores de ovocitos más utilizados [ REPRODUCCIÓN HUMANA; Van den Abbeel,E; 22(7):1959-1972 (2007) ]. Sin embargo, a diferencia de los ovocitos humanos, para los ovocitos de ratón, la permeabilidad del etilenglicol (EG) es comparable a la del DMSO, el propilenglicol (PG) y la acetamida (AA), pero no al glicerol (Gly) [ REVISTA DE REPRODUCCIÓN Y DESARROLLO; Pedro, PB; 51(2):235-246 (2005) ].
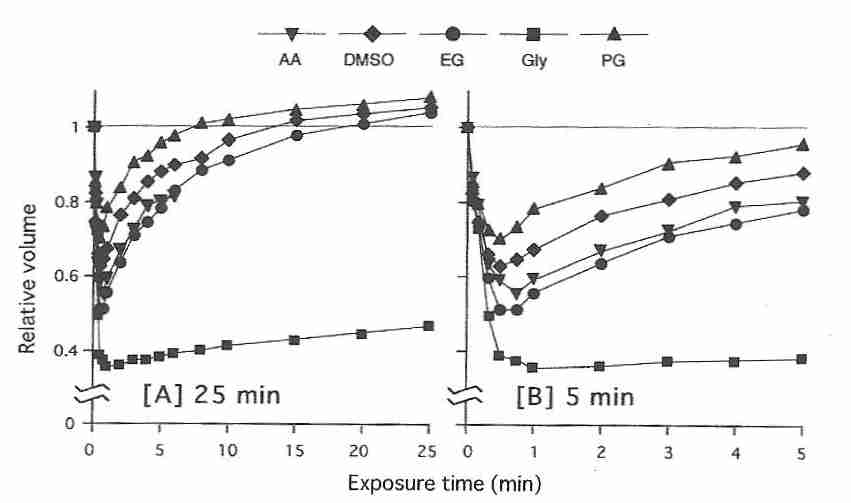 |
Tanto el agua como los crioprotectores cruzan las membranas celulares más lentamente a temperaturas más bajas. Los crioprotectores retardan el paso del agua a través de las membranas celulares. El glicerol, el DMSO y el etilenglicol reducen la velocidad a la que el agua atraviesa las membranas de los espermatozoides humanos en más de la mitad [ BIOLOGÍA DE LA REPRODUCCIÓN; Gilmore,JA; 53(5):985-995 (1995) ].
Aparte de la elección de los crioprotectores, una preocupación importante es la forma en que se administra el crioprotector. Por ejemplo, el glicerol (el crioprotector estándar utilizado en criónica durante muchos años) puede administrarse sin diluir o puede introducirse en concentraciones que aumentan gradualmente. En condiciones óptimas, el glicerol produce un 80 % de vitrificación y un 20 % de formación de hielo. El glicerol ha sido reemplazado por mejores crioprotectores que pueden vitrificarse sin formación de hielo, pero normalmente usaré glicerol como crioprotector de ejemplo. Probablemente no se deba perfundir a un paciente con una solución de glicerol al 100% u otro crioprotector debido a la posibilidad de daño osmótico. Es prudente comenzar la perfusión con bajas concentraciones de crioprotector porque el agua puede difundirse fuera de las células miles de veces más rápido que la difusión del crioprotector hacia el interior de las células. El uso de concentraciones gradualmente crecientes de crioprotector (ramping) previene el daño osmótico que podría causar este diferencial.
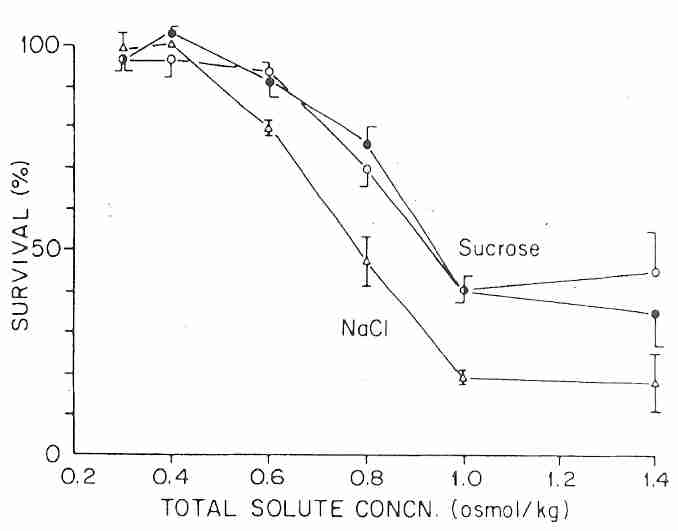 |
Los granulocitos humanos (que son más vulnerables al estrés osmótico o al encogimiento que la mayoría de los otros tipos de células) pueden experimentar una solución hipertónica de hasta 600 mOsm/kgH 2 O (que encoge las células al 68% del volumen celular normal) durante 5 minutos a 0ºC sin más del 10% de las células pierden la integridad de la membrana. Pero a aproximadamente 750 mOsm/kgH 2 O (NaCl) o 950 mOsm/kgH 2 O (sacarosa), menos de la mitad de los granulocitos muestran membranas intactas cuando se devuelven a la solución isotónica. No obstante, las células no mostraron lisis si se mantuvieron en medio hiperosmótico. De hecho, los granulocitos pueden tolerar hasta 1400 mOsm/kgH 2 O si no se diluyen posteriormente a menos de 600 mOsm/kgH 2 O [REVISTA AMERICANA DE FISIOLOGÍA; Armitage WJ; 247 (5 parte 1): C373-381 (1984) ]. Un estudio de confirmación posterior mostró que la rehidratación de las células PC3 encogidas por la solución de NaCl crea más daño osmótico que la deshidratación inicial [ CRYOBIOLOGY; Zawlodzka,S; 50(1):58-70 (2005) ]. La supervivencia celular tras la rehidratación fue mayor a 0ºC que a 23ºC.
Aunque los efectos tóxicos del glicerol 2 M (17 % p/p) sobre los granulocitos son bastante evidentes a 22 °C, casi no se observa ningún efecto tóxico a 0 °C [CRIOBIOLOGÍA; Frim, J; 20(6):657-676 (1983)]. Para ninguna célula de mamífero que no sean granulocitos es tóxico el glicerol 2 Molar. No obstante, la adición abrupta de solo glicerol 0,5 molar a 0ºC dio como resultado que solo sobreviviera el 40% de los granulocitos cuando se diluyó lentamente en una solución isotónica y se calentó a 37ºC. Sólo el 20% de los granulocitos sobrevivieron a este tratamiento cuando se añadió glicerol 1 Molar o 2 Molar (no hubo diferencia en la supervivencia entre las dos concentraciones). Pero si se añadía sacarosa o NaCl para mantener los granulocitos reducidos al 60% del volumen celular normal, casi todos los granulocitos sobrevivían cuando se incubaban a 37ºC. En la medida en que la contracción transitoria de los granulocitos debida al glicerol no sea inferior al 85 % del volumen celular normal,REVISTA AMERICANA DE FISIOLOGÍA; Armitage WJ; 247 (5 parte 1): C382-389 (1984) ].
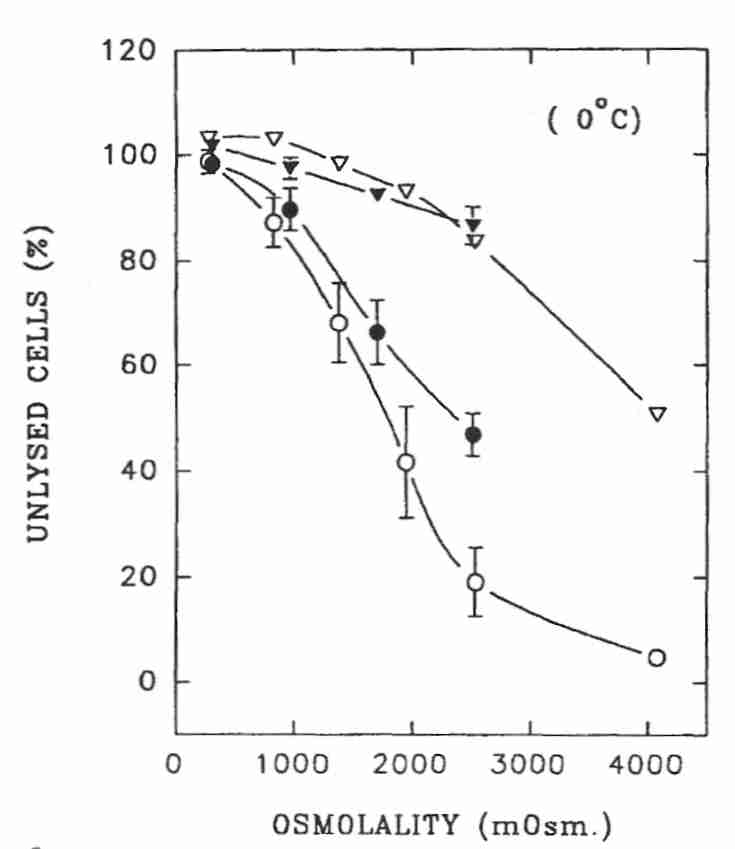 |
Los espermatozoides humanos toleran una osmolalidad mucho mayor que los granulocitos. Los espermatozoides pueden experimentar una solución hipertónica de hasta 1000 mOsm/kgH 2 O durante 5 minutos a 0ºC sin que más del 10 % de las células pierdan la integridad de la membrana. Aproximadamente a 1500 mOsm/kgH 2 O (NaCl, círculos blancos) o 2500 mOsm/kgH 2 O (sacarosa, círculos negros), menos de la mitad de los espermatozoides muestran membranas intactas cuando se devuelven a condiciones isotónicas. Pero el 80% de los espermatozoides mostraron una membrana celular intacta después de la exposición a 2500 mOsm/kgH 2O a 0ºC si se mantiene en hipertonicidad en lugar de restaurar a solución isotónica (NaCl y sacarosa, triángulos). Los espermatozoides volvieron gradualmente a la solución isotónica después de la exposición a glicerol 1,5 molar a 22ºC y mostraron solo un 3 % de lisis, mientras que el 20 % de los espermatozoides se lisaron si el regreso a la solución isotónica fue repentino. No se observó lisis para los espermatozoides que no regresaron al medio isotónico. A casi 5000 mOsm/kgH 2 O de glicerol (alrededor de 4,5 molar), el 17 % de los espermatozoides mostraron lisis (perdieron la integridad de la membrana) a 0 °C y el 10 % tuvieron lisis a 8 °C si no se devolvían a medios isotónicos [ BIOLOGÍA DE LA REPRODUCCIÓN; Gao,DY; 49(1):112-123 (1993) ]. Para propósitos de criónica, sería mejor mantener las células en condiciones hipertónicas para maximizar la viabilidad potencial durante el almacenamiento criogénico.
Las células de riñón de ratón (IMCD, Inner Medullary Collecting Duct) pueden ser destruidas por NaCl o urea de 700 mOsm/kgH 2 O, pero la muerte es apoptótica y tarda hasta 24 horas. Las células IMCD pueden tolerar hasta 900 mOsm/kgH 2 O de urea y NaCl en combinación debido a la activación de defensas celulares complementarias (incluida la proteína de choque térmico) [ AMERICAN JOURNAL OF PHYSIOLOGY; Santos,BC; 274(6):F1167-F1173 1998) ].
Casi la mitad de los fibroblastos de ratón mostraron lisis de la membrana celular después de la restauración de la isotonicidad después de la exposición al equivalente de 3600 mOsm/kgH 2 O de estrés osmótico por la adición rápida de DMSO 4 molar (30 % p/p) a 0 °C. Pocas células resultaron dañadas por la adición lenta de DMSO [ BIOPHYSICAL JOURNAL; MuldrewK; 57(3):525-532 (1990) ].
Las células epiteliales de la córnea humana podrían tolerar glicerol 4,3 M (37 % p/p) con solo un 2 % de pérdida celular a 4 °C si las células se sometieran a un aumento gradual de la concentración (duplicando la osmolalidad en aproximadamente 13 minutos), pero para aumentos escalonados de 0,5 M cada 5 minutos por encima de 2 M (17 % p/p) a 3,5 M (30 % p/p) de glicerol a 0 ºC hubo una pérdida de células del 27 %. Para el mismo método en rampa con DMSO hubo una pérdida de células del 6 % a 2 M (15 % p/p) y una pérdida de células del 15 % a 3 M (23 % p/p). El mismo método escalonado para DMSO dio como resultado una pérdida celular del 1,5 % para las células escalonadas de 2 M a 3,5 M (27 % p/p) y una pérdida celular del 22 % para las células escalonadas de 2 M a 4,3 M (33 % p/p). ). En todos los casos se evaluó la viabilidad celular tras lavado y tres días de incubación a 37ºC [CRIOBIOLOGÍA; Bourne, WM; 31(1):1-9 (1994)]. (La conversión de la molaridad del glicerol a %p/p se aproximó multiplicando por 8.
En el contexto de la criónica, debe recordarse que las células no vuelven a la temperatura corporal y no es necesario que vuelvan a la isotonicidad antes de la crioconservación. Habría poco tiempo para la apoptosis y la mayoría de las células se conservarían mucho mejor a baja temperatura y en una solución hiperosmolar. Las tecnologías futuras pueden prevenir la apoptosis y tener mejores métodos para restaurar las células insustituibles a temperaturas y osmolalidades normales. Para las neuronas, es probable que incluso la perfusión escalonada abrupta con crioprotector resulte efectivamente en una perfusión acelerada cuando se tienen en cuenta los tiempos de difusión requeridos a través de los vasos sanguíneos (barrera hematoencefálica) y el espacio intersticial.
La contracción celular puede dañar directamente la célula (y la membrana celular) debido a la resistencia estructural del citoesqueleto celular y la alta compresión de otros constituyentes celulares [ REPRODUCCIÓN HUMANA; Gao,DY; 10(5):1109-1122 (1995) ]. Además del daño de la membrana, se producen otras formas de daño celular debido a los entornos hipertónicos, incluido el entrecruzamiento de proteínas intracelulares posterior a la deshidratación celular. Los espermatozoides de toro pierden motilidad (a menudo solo temporalmente) en un medio menos hipertónico que uno que causa daño a la membrana [ JOURNAL OF DAIRY SCIENCE; Liu,Z; 81(7):1868-1873 (1998) ]. El estrés osmótico puede deprimir el potencial de la membrana mitocondrial de una manera que en su mayoría es reversible después de la restauración a las condiciones isotónicas.ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE.UU.); Desai, BN; 99(7):4319-4324 (2002) ]. Los ovocitos humanos sometidos a 600 mOsm/kgH 2 O de sacarosa mostraron un 44 % de husos metafásicos II con anomalías [ REPRODUCCIÓN HUMANA; Mullen, SF; 19(5):1148-1154 (2004) ]. Las soluciones hipertónicas pueden desencadenar la apoptosis [ AMERICAN JOURNAL OF PHYSIOLOGY; Copp,J; 288(2):C403-C415 (2005) ].
A pesar de estos otros tipos de daño debido a la hiperosmolalidad, los mayores riesgos en la perfusión crioprotectora en criónica son los asociados con el daño de la membrana y el edema debido a la inflamación celular. La evidencia de que mantener la hipertonicidad protege más a las células que volver a las condiciones isotónicas, y el deseo de minimizar el edema durante la perfusión parece aconsejar en criónica perfundir en condiciones hipertónicas.
VI. PERFUSIÓN CRIOPROTECTORA
Una vez que el paciente está en las instalaciones de criónica, la solución de transporte se puede reemplazar con una solución crioprotectora. Una temperatura de perfusión de 10 ºC ofrece el mejor compromiso de evitar la alta viscosidad de temperaturas más bajas y, al mismo tiempo, limitar la degradación tisular isquémica , el daño por frío y la toxicidad crioprotectora que se observaría a temperaturas más altas. (Los crionicistas generalmente se preocupan más por el daño isquémico que por la toxicidad de los crioprotectores debido a la creencia de que el daño isquémico tiene una mayor probabilidad de ser irreversible, irreparable por la futura tecnología de reparación molecular).
Los crioprotectores deben esterilizarse para evitar el crecimiento de bacterias. La esterilización de los crioprotectores por calentamiento puede causar la formación de dobles enlaces carbono-carbono, que son evidentes por un amarillamiento del crioprotector. Solo unos pocos enlaces dobles de este tipo pueden producir la apariencia amarilla, por lo que el hecho de amarillear no es evidencia de que el crioprotector ya no sea útil. Pero un método preferible de esterilización crioprotectora es la filtración a través de un filtro de 0,2 micras.
La adición rápida de crioprotectores hace que las células endoteliales se encojan, rompiendo así las uniones entre las células [ CRIOBIOLOGÍA; Pollock,GA; 23(6):500-511 (1986) ]. Por otro lado, la contracción de las células endoteliales por la perfusión hipertónica puede aumentar el volumen capilar, aumentando así el flujo sanguíneo, siempre que no se produzca un daño vascular excesivo. A menudo se observa que la sangre y los coágulos se desprenden durante la perfusión de crioprotectores en casos de criónica.. Para fines de criónica, cierto daño vascular puede ser una ventaja en la medida en que aumenta la difusión, y la reparación vascular puede ser una tarea fácil para la ciencia del futuro. De hecho, la ruptura de la barrera hematoencefálica en el rango de glicerol molar 1.8-2.2 es esencial para la perfusión del cerebro, siempre que se pueda evitar el edema tisular dañino (hinchazón). La expresión de acuaporinas (canales de agua) en la barrera hematoencefálica podría ser un medio más seguro para permitir que los crioprotectores ingresen al cerebro [CRYOBIOLOGY; Yamaji,Y; 53(2):258-267 (2006)].
La perfusión de circuito cerrado (con la solución de perfusión siguiendo un circuito tanto dentro como fuera del cuerpo del paciente) se contrasta con la perfusión de circuito abierto utilizada por los directores de funerarias para el embalsamamiento. En la perfusión de circuito abierto del embalsamamiento, se bombea líquido a una arteria grande del cadáver y se expulsa sangre de una vena grande, y esta sangre se desecha.
Se puede configurar una perfusión de circuito cerrado, como se ilustra en el diagrama, a bajo costo para la introducción gradual de crioprotectores en pacientes con criónica. Como se muestra en el diagrama, el circuito de perfusión no pasa por el corazón. El perfundido ingresa al paciente a través de una cánula en la arteria femoral (pierna) y sale de una cánula en la vena femoral de la misma pierna. Fluyendo hacia arriba (en dirección opuesta a la habitual) desde la arteria femoral y hacia arriba a través de la aorta descendente, el perfundido ingresa al arco de la aorta (por donde la sangre normalmente sale del corazón), pero se bloquea su entrada al corazón. En cambio, el perfundido fluye (en la dirección habitual) a través de las arterias de distribución de la aorta, en particular hacia la cabeza y el cerebro. Volviendo en las venas (en la dirección habitual), sin embargo, el perfundido pasa nuevamente por alto el corazón y fluye hacia abajo (en dirección opuesta a la habitual) hacia la vena femoral, donde sale. Sin embargo, una mejor alternativa al circuito femoral es abrir quirúrgicamente el tórax para canular la aorta del corazón (para la entrada) y la aurícula (para la salida).
![[ Perfusión de circuito cerrado de un paciente de criónica ]](https://benbest.com/cryonics/perfuse.gif) |
Aunque no se muestra en el esquema, habrá una bomba en el circuito para mantener la presión y el movimiento del fluido. Se debe utilizar una bomba de rodillos , en lugar de una bomba de embalsamador. Una bomba de rodillos logra la acción de bombeo mediante el uso de rodillos en el exterior de la tubería flexibleque fuerza los fluidos a través del tubo sin contaminar esos fluidos. Las bombas de embalsamador pueden usar presiones mucho más altas que las adecuadas para la criónica, lo que da como resultado daños en los vasos sanguíneos. Las bombas de embalsamador también se contaminan fácilmente (y son difíciles de limpiar), a menos que se use un filtro. La contaminación no importa mucho en el embalsamamiento, pero en la criónica, los contaminantes que ingresan al paciente a través de la bomba pueden dañar los vasos sanguíneos e interferir con la perfusión. Si se utiliza una bomba de embalsamador con fines criogénicos, asegúrese de que la presión pueda reducirse a un nivel adecuado y que esté limpia y esterilizada. La principal ventaja de las bombas de rodillos, sin embargo, es el hecho de que proporcionan un circuito cerrado, mientras que las bombas de embalsamador son de circuito abierto. Las bombas de rodillos generalmente se calibran en litros por minuto.
Los microémbolos gaseosos y de partículas pueden producir isquemia en capilares y arteriolas . Un estudio de pacientes que se sometieron a una cirugía de derivación cardiopulmonar de rutina mostró que un 16 % menos de pacientes tenían déficits neuropsicológicos ocho semanas después de la cirugía cuando se había utilizado un filtro de línea arterial de 40 micrómetros [ACV; Pugsley,W; 25(7):1393-1399 (1994)]. Tanto las bombas de rodillos (bombas peristálticas ) como las bombas centrífugas pueden generar partículas de hasta 25 micrómetros de diámetro por espalación, aunque las bombas centrífugas generan menos partículas [PERFUSIÓN; Merkle,F; 18 (suplemento 1): 81-88 (2003)]. La filtración del perfundido con un filtro de 0,2 micrómetros antes de la perfusión es una forma recomendada de eliminar posibles microémbolos, incluidas las bacterias. A temperatura ambiente, las burbujas de aire de 20 micrómetros de diámetro tardan de 1 a 6 segundos en disolverse en agua, aunque las altas tasas de flujo y la turbulencia pueden aumentar la formación de microburbujas [ SEMINARIOS EN DIÁLISIS; Barac, M; 21(3):232-238 (2008) ]. La desaireación de los tubos antes de la perfusión reduce considerablemente la posibilidad de que entren microburbujas en el paciente [ EL CIRUJANO TORÁCICO Y CARDIOVASCULAR; Stock,UA; 54(1):39-41 (2006) ].
Se considera que la Presión Arterial Media (MAP) para un adulto normal está en el rango de 50 a 150 mmHg, y la Presión de Perfusión Cerebral (CPP) está en el mismo rango [ BRITISH JOURNAL OF ANAETHESIA; Steiner, LA; 91(1):26-38 (2006) ]. La presión vascular normalmente cae a alrededor de 40 mmHg en las arteriolas, a menos de 30 mmHg al entrar en los capilares, y baja a 3 a 6 mmHg ( presión venosa central , CVP) cuando regresa a la aurícula derecha del corazón. Perfundir a un paciente criónico a aproximadamente 120 mmHg debería abrir los capilares adecuadamente para una buena saturación del tejido crioprotector sin dañar los vasos sanguíneos frágiles.
Fuera del paciente, parte del drenaje se descarta, pero la mayor parte se devuelve a un reservorio circulante (agitado) conectado a un reservorio concentrado de crioprotector. El depósito circulante es inicialmente una solución portadora.que gradualmente se vuelve cada vez más concentrado con crioprotector a medida que avanza la agitación y la recirculación. El depósito de circulación se puede agitar desde la parte inferior mediante una barra de agitación magnética en una mesa de agitación y/o desde la parte superior mediante un dispositivo de agitación tipo batidor de huevos. La agitación extraerá el crioprotector del depósito de crioprotector y el bombeo de la perfusión también debería extraer activamente líquido del depósito de crioprotector. Gradualmente, se incluye una concentración cada vez mayor de crioprotector en el perfundido y se evita el choque osmótico del crioprotector de concentración completa.
La solución de transporte para el crioprotector debe realizar funciones de conservación de tejido similares a las que realiza la solución de transporte, y debe mezclarse cuidadosamente con el crioprotector para evitar desviaciones de la isotonicidad que podrían provocar deshidratación o hinchazón y explosión de las células. La solución portadora ayudará a mantener vivas las células durante la perfusión del crioprotector.
Una excelente solución portadora para propósitos de criónica sería la RPS-2 (Renal Preservation Solution número 2), que fue desarrollada por el Dr. Gregory Fahy en 1981 como resultado de estudios en cortes de riñón. Más recientemente, el Dr. Fahy usó RPS-2 como solución portadora en la crioconservación de cortes de hipocampo , una indicación de que es adecuada para el tejido cerebral y para el riñón. RPS-2 no solo ayuda a mantener la viabilidad de los cortes del hipocampo, sino que reduce la cantidad de crioprotector necesaria porque tiene propiedades crioprotectoras (coligativas) propias. La formulación de RPS-2 es: K2HPO4 , 7,2 mM; glutatión reducido, 5 mM; clorhidrato de adenina, 1 mM; dextrosa, 180 mM; KCl, 28,2 mM; NaHCO3 , 10 mM; más calcio y magnesio [CRIOBIOLOGIA; Fahy, GM; 27(5):492-510 (1990) ]. LM5 (Lactose-Mannitol 5) es una solución portadora para usar en soluciones de vitrificación que incluyen bloqueadores de hielo . LM5 no contiene dextrosa, que se cree que interfiere con los bloqueadores de hielo.
El reservorio de crioprotector no contendrá en general crioprotector puro (aunque en principio podría), sino una solución de "concentración terminal" de crioprotector que es igual o ligeramente superior a la concentración objetivo final. A medida que avanza la perfusión y el drenaje para el desecho, el nivel de ambos reservorios cae en tándem hasta que ambos reservorios están casi vacíos, momento en el cual la concentración del circuito habrá alcanzado la concentración del reservorio crioprotector. Siempre que los dos embalses tengan el mismo tamaño y la misma elevación vertical, el gradiente será lineal en el tiempo (si la tasa de drenaje a descartar fuera constante).
Para que el crioprotector se perfunda en las células, debe haber una exposición constante al crioprotector que rodea las células, y debe haber presión para mantener esa exposición. En un animal vivo, el corazón mantiene la presión sanguínea que fuerza la sangre a través de los capilares y fuerza los nutrientes hacia las células. Un animal muerto sin presión arterial, y que está siendo perfundido con crioprotector, también requiere presión para que los capilares permanezcan abiertos y para que el crioprotector se mantenga en altas concentraciones alrededor de las células.
Alcor encontraron que la perfusión de circuito cerrado debe mantenerse durante 5 a 7 horas para el equilibrio completo del glicerol, porque la velocidad de difusión del agua fuera de las células es miles de veces la velocidad a la que el glicerol ingresa a las células. Por supuesto, sería posible bombear glicerol a un paciente durante 5 a 7 horas con perfusión de circuito abierto, pero solo usando miles de dólares en glicerol. Los crioprotectores de vitrificación más nuevos utilizados por Alcor son mucho más caros que el glicerol. Cuando se utilizan crioprotectores costosos, tiene mucho más sentido recircular en un circuito cerrado. La perfusión de circuito cerrado también tiene la ventaja de permitir la monitorización continua de los cambios fisiológicos que se producen en el cuerpo del paciente durante el proceso de perfusión. El circuito abierto con un crioprotector económico tiene la ventaja de evitar la recirculación de toxinas.
Los crioprotectores, particularmente el glicerol, son viscosos, y los crioprotectores en altas concentraciones son particularmente viscosos. Debe evitarse la introducción de burbujas de aire en las soluciones crioprotectoras durante el vertido y la mezcla porque los émbolos de aire que ingresan al paciente criogénico pueden bloquear la perfusión. La eliminación de las burbujas de aire de las soluciones crioprotectoras viscosas es extremadamente difícil. La prevención es más efectiva que la cura. El crionicista Mike Darwin escribió sobre este problema y sus posibles soluciones en un mensaje de CryoNet de 1994 .
La mezcla inadecuada de perfundido que contiene altos niveles de crioprotector puede resultar en un fenómeno que apareceser de alta viscosidad, pero en realidad es edema. Si, por ejemplo, la solución portadora isotónica se mezcla mitad y mitad con solución crioprotectora, es posible que se deba detener una perfusión de circuito abierto cuando no entre más perfusión en el paciente. El problema no es causado por la viscosidad, sino por el hecho de que la solución isotónica se volvió hipotónica debido a la dilución con el crioprotector, lo que provocó que las células se hincharan y obligaran a detener la perfusión. En la perfusión de circuito cerrado, el reservorio del concentrado crioprotector contiene crioprotector a aproximadamente el 125 % de la concentración terminal en un vehículo de solución portadora isotónica, de modo que cuando el concentrado del reservorio se mezcla con el portador isotónico no hay cambios en la tonicidad.
Los crioprotectores más nuevos son menos viscosos que el glicerol, por lo que las perfusiones se pueden realizar en menos tiempo. Después de 15 minutos de perfusión con la solución portadora, la concentración del crioprotector aumenta linealmente a una velocidad de 50 milimolares por minuto hasta que se alcanza la concentración total, en unas dos horas (un protocolo desarrollado sobre la base de minimizar el daño osmótico al perfundir los riñones). La perfusión se aumenta durante una o dos horas adicionales hasta que el crioprotector se haya difundido completamente en las células (como lo indica la similitud de las concentraciones de crioprotector de aflujo y eflujo).
Solo después de unas pocas horas de perfusión de circuito cerrado, la concentración de crioprotector que sale del paciente de criónica es igual a la concentración de crioprotector que ingresa al paciente. Solo un período prolongado de presión sostenida mantendrá los capilares abiertos y, de lo contrario, facilitará la difusión del crioprotector en las células. Y la concentración de crioprotector de salida será igual a la concentración de crioprotector de entrada solo cuando los tejidos estén completamente cargados con crioprotector. Se utiliza un refractómetro para verificar que se haya alcanzado la concentración terminal de crioprotector en el cerebro.
(Un refractómetro mide el índice de refracciónde un líquido, es decir, la relación entre la velocidad de la luz en el líquido y la velocidad de la luz en el vacío (o aire). La luz cambia de velocidad cuando incide en el límite de dos medios, lo que provoca un cambio de ángulo si incide en el nuevo medio en un ángulo. Debido a que el índice de refracción es una relación de dos cantidades que tienen las mismas unidades, no tiene unidades. El vapor de sodio en un arco eléctrico produce una excitación entre los orbitales 3s y 3p que da como resultado una luz amarillo-naranja de 589nm, lo que Joseph Fraunhofer llamó la "línea D". En la medida en que la "línea D" de sodio fue la primera fuente conveniente de luz monocromática, se convirtió en el estándar para la refractometría. El índice de refracción de un líquido es, por lo tanto, un número de 5 dígitos de alta precisión entre 1,3000 y 1,7000 a una temperatura específica, medida en la longitud de onda de la línea D del sodio. Por ejemplo,D 25 - es 1.4730.)
La perfusión de circuito cerrado puede ser necesaria para la eliminación de agua, así como la carga de crioprotector si es cierto que la perfusión de circuito abierto no puede eliminar el agua de manera efectiva.
Uno podría imaginar que el tiempo adicional dedicado a la perfusión de circuito cerrado (en lugar de circuito abierto) significa un mayor daño debido a la temperatura por encima de cero. Pero la mayoría de las células siguen vivas y se metabolizan muy lentamente a 10ºC. Viaspan®, RPS-2 y otras soluciones de conservación de órganos están diseñadas para mantener vivos los tejidos durante períodos prolongados a temperaturas cercanas a cero, sin duda durante el tiempo necesario para la perfusión de circuito cerrado. El aumento gradual (aumento lento de la concentración) del crioprotector debe realizarse de tal manera que la concentración de iones y manitol o lactobionato permanezca sin cambios en el perfundido. Sin embargo, la aceleración no es un proceso osmóticamente neutro porque se espera que el crioprotector deshidrate los tejidos.
El aumento gradual de la concentración de glicerol a una velocidad de 2-4 molar por hora es lo suficientemente lento como para permitir la difusión completa de glicerol en los tejidos. El encogimiento celular debido a la difusión de agua desde las células es seguido por un lento hinchamiento celular debido a la difusión gradual de glicerol en las células. La deshidratación de las células epiteliales en los vasos sanguíneos por aumento de glicerol facilita la perfusión al ensanchar los vasos. Si la velocidad de rampa es demasiado lenta, las células epiteliales se cargan con glicerol lo suficientemente rápido como para perder la ventaja de ensanchar los vasos.
Se debe tener cuidado de que la concentración de solutos no penetrantes (como el manitol) en la solución portadora no sea inferior a la que hay en las células, normalmente una concentración de 300 mOsm/kgH 2 O. Si la concentración de solutos no penetrantes en la solución portadora es hipotónica, por ejemplo, 150 mM, las células se hincharán hasta el doble de su volumen independientemente de la concentración de glicerol. Esta hinchazón se produciría primero en las células epiteliales, lo que podría dificultar seriamente el proceso de perfusión. Una rampa más rápida disminuiría este efecto por la deshidratación de las células epiteliales, pero el aumento de la velocidad sería demasiado rápido para permitir la difusión completa del glicerol en los tejidos. Es mejor evitar estos problemas manteniendo una concentración de solución portadora de solutos no penetrantes de al menos 300 mOsm/kgH 2O, y probablemente menos de 600 mOsm/kgH 2 O.
Aunque históricamente el glicerol ha sido el crioprotector utilizado en la criónica, el proceso de perfusión descrito debería ser muy similar al de los crioprotectores más nuevos y efectivos que se utilizan ahora en la criónica. La toxicidad de los crioprotectores varía directamente con la temperatura, pero la viscosidad de los crioprotectores varía inversamente con la temperatura. Por lo tanto, existe una compensación entre perfundir a una temperatura más alta para una penetración crioprotectora más rápida y sufrir la mayor toxicidad de una temperatura más alta. Sin embargo, a diferencia del daño osmótico, la toxicidad puede afectar la viabilidad a través de daños bioquímicos en lugar de estructurales y, por lo tanto, ser menos preocupante para futuras reparaciones. lesión isquémicaes probable que sea mínimo debido a los nutrientes y el oxígeno en la solución portadora. por más tiempo a una temperatura más alta, sin embargo, es probable que aumente el daño estructural.
Algunos protocolos de criónica comienzan con la introducción de crioprotector a 10ºC y terminan a 5ºC. Un objetivo a corto plazo es poder introducir la mitad del crioprotector a 10ºC y la otra mitad a -10ºC. Parece una buena estrategia agregar primero los componentes menos tóxicos de un cóctel de crioprotectores (a temperaturas más altas) y los componentes más tóxicos a temperaturas más bajas, o simplemente aumentar la concentración de crioprotectores a medida que desciende la temperatura. (Esta técnica se utilizó con éxito en el Proyecto de criopreservación de cortes de hipocampo ).
VIII. PERFUSIÓN DE CABEZA
| Arteria carótida y vertebral | Círculo de Willis en contexto | Círculo de Willis |
|---|---|---|
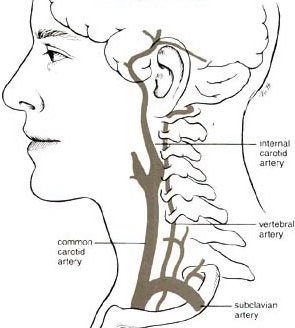 | 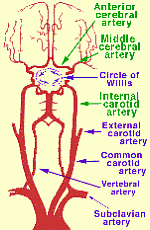 | 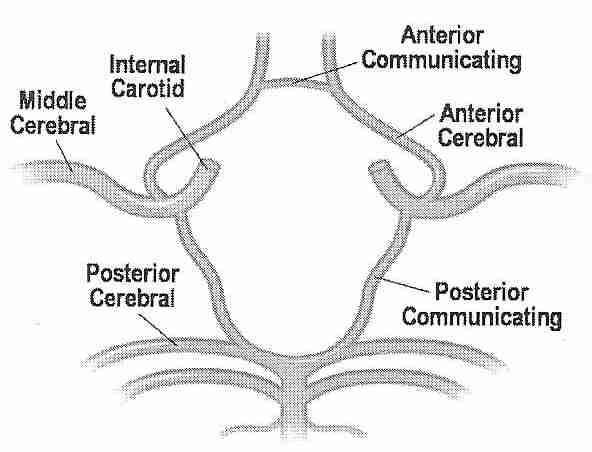 |
La perfusión de cabezas, en lugar de cuerpos enteros, puede ser un desafío debido a los complejos requisitos vasculares y particulares. Dos arterias grandes (las arterias carótidas ) y dos arterias pequeñas (las arterias vertebrales ) irrigan la cabeza, mientras que todo el retorno venoso de la cabeza llega a través de las venas yugulares . Las arterias carótidas y las arterias vertebrales se unen en la cabeza, sin embargo, en el Círculo de Willis ., lo que debería significar que las arterias vertebrales son algo redundantes, y que la perfusión cerebral completa debería ser posible mediante la simple perfusión en las arterias carótidas. Pero el Círculo de Willis a menudo está incompleto. Por esa razón, se ha hecho un gran esfuerzo en criónica para perfundir la cabeza a través de las arterias carótida y vertebral.
Un enfoque ha sido cortar el esternón ( esternotomía mediana ) para abrir el tórax y acceder a la aorta, de modo que se pueda acceder a todos los vasos sanguíneos de la cabeza por debajo de donde se separan. Pinzar la aorta ascendente (que va a la parte inferior del cuerpo) y las arterias subclavias (que van a los brazos) significa que la perfusión en la aorta ascendente perfundirá principalmente la cabeza y el cuello (a través de las carótidas y las vértebras). Pinzar las arterias subclavias no siempre es fácil de hacer y, en algunos casos, se han aplicado torniquetes en los brazos para evitar la perfusión. Con este enfoque, la vena cava superior se puede canular para el muestreo de efluentes del índice de refracción.(para determinar la saturación del cerebro/cabeza con solución de vitrificación). Canular la vena cava superior es más fácil que canular las venas yugulares, pero verificar el índice de refracción de las venas yugulares permite monitorear la saturación de la solución de vitrificación de ambos hemisferios cerebrales de forma independiente.
Para la neuroperfusión (solo de la cabeza) , Alcor actualmente extrae la cabeza del cuerpo ("aislamiento cefálico") y perfunde la cabeza de forma independiente. La perfusión se realiza en las carótidas, con el drenaje de las yugulares recogido, filtrado y recirculado de vuelta a las carótidas. No se intenta perfundir en las vértebras a menos que no se vea que el perfundido gotea de las vértebras (lo que significaría que el círculo de Willis está incompleto, en cuyo caso se canularían las vértebras para la perfusión).
En un estudio, los angiogramas por resonancia magnética de voluntarios adultos sanos mostraron un Círculo de Willis completo en solo el 42 % de los casos, más a menudo completo en personas más jóvenes y mujeres [ RADIOLOGÍA; Krabbe-Hartkamp,MJ; 207(1):103-111 (1998) ]. En un estudio de angiografía por resonancia magnética de voluntarios sanos en el grupo de edad de 65 a 68 años, el 47 % tenía un Círculo de Willis completo [ JOURNAL OF CARDIOVASCULAR SURGERY; Macchi,C; 43(6):887-890 (2002) ]. Se ha visto una correlación entre imágenes de resonancia magnética del Círculo de Willis incompleto y flujos sanguíneos deficientes en arterias provenientes del Círculo de Willis [ AMERICAN JOURNAL OF NEURORADIOLOGY; Tanaka,H; 27(8):1770-1775 (2006)]. Un estudio que encontró un Círculo de Willis incompleto en el 33 % de todos los sujetos encontró que el Círculo de Willis estaba incompleto en el 51 % de los sujetos que tenían migrañas [ DOLOR DE CABEZA; Bugnicourt,J; 49(6):879-886 (2009) ]. En los casos de oclusión de la arteria carótida interna, la ausencia de la arteria comunicante posterior ipsilateral del Círculo de Willis aumenta la probabilidad de infarto isquémico [ NEW ENGLAND JOURNAL OF MEDICINE; Schomer,DF; 330(22):1565-1570 (1994)]. No obstante, un estudio que encontró que el Círculo de Willis estaba completo en 59 de 99 pacientes no encontró ningún caso de perfusión insuficiente en las pruebas funcionales, concluyendo que la circulación colateral extracraneal proporciona una vía alternativa al Círculo de Willis para la perfusión cruzada cerebral [ EUROPEAN JOURNAL DE CIRUGÍA CARDIO-TORÁCICA; Urbanski, PP; 33(3):402-408 (2008) ]. La buena circulación colateral es un factor de pronóstico favorable para las víctimas de accidentes cerebrovasculares [ REVISIONES ACTUALES DE CARDIOLOGÍA; Romero,JR; 5(4):279-288 (2009) ].
Para un análisis más detallado de los problemas relacionados con el Círculo de Willis y la perfusión del paciente, consulte: El Círculo de Willis en la Perfusión Criónica
VIII. LA BARRERA SANGRE-CEREBRO
En la medida en que llevar crioprotectores al cerebro es un objetivo principal de la criónica, comprender la naturaleza de la "barrera" entre el plasma sanguíneo y el cerebro es un asunto de importancia primordial.
| Pared capilar típica | Capilar típico versus capilar BBB |
|---|---|
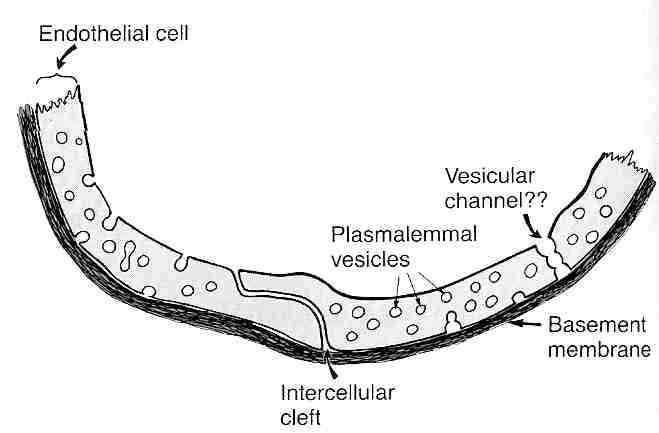 | 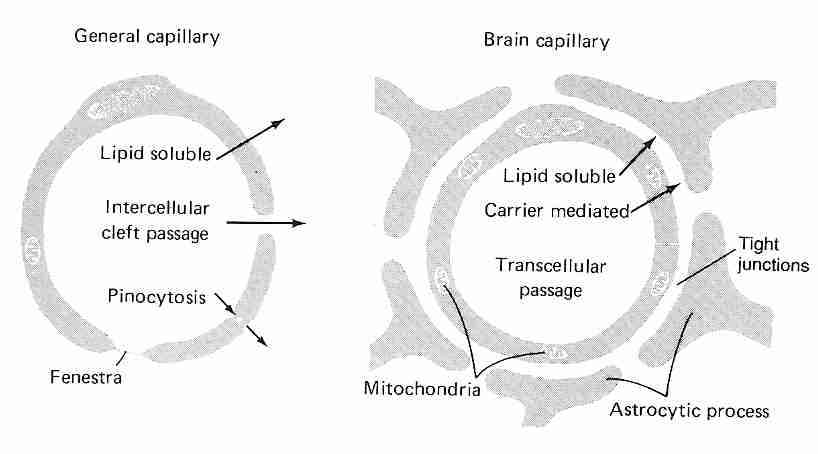 |
La difusión a través de las paredes capilares es el medio por el cual la mayoría de las sustancias se transfieren entre el torrente sanguíneo y el líquido intersticial (el líquido entre las células de los tejidos corporales). Los capilares son tubos de paredes delgadas compuestos por una sola capa de células endoteliales altamente permeables que se encuentran sobre una delgada membrana basal. Las moléculas solubles en lípidos como el etanol , la nicotina y el diazepam, así como los gases como el oxígeno y el dióxido de carbono, se difunden directamente a través de las membranas capilares. Los espacios entre las células endoteliales adyacentes ( hendiduras intercelulares ) permiten la difusión de sustancias solubles en agua, al igual que los canales a través de las paredes de las células endoteliales ( fenestras )., "ventanitas"). Las vesículas de plasmalema permiten la pinocitosis (transporte de vesículas) de sustancias a través de la membrana. Las hendiduras intercelulares en el hígado son tan anchas que las proteínas plasmáticas pueden pasar directamente de la sangre al tejido hepático. Las fenestras son tan grandes en los riñones que las sustancias pueden filtrarse en los glomérulos sin tener que pasar por las hendiduras intercelulares.
| Unión estrecha, normal versus con glioma |
|---|
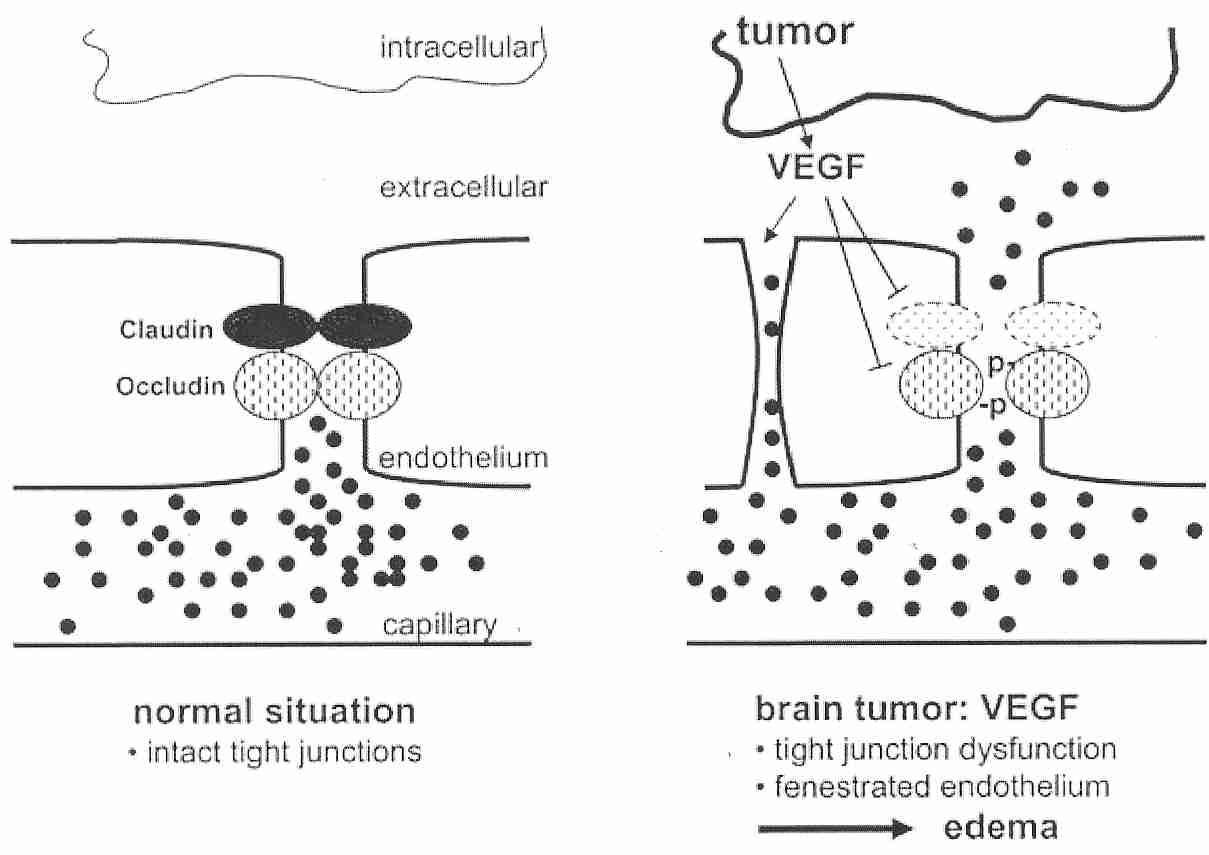 |
Por el contrario, las células endoteliales de los capilares cerebrales están tan apretadas que no hay hendiduras intercelulares, aunque existen uniones estrechas que están reguladas por una serie de proteínas transmembrana que responden a la señalización intracelular. Las uniones estrechas tienen una alta resistencia eléctrica, proporcionando una barrera a los iones. Además, no hay fenestras y hay poca o ninguna pinocitosis en las células endoteliales de los capilares cerebrales [ REVISIONES FARMACOLOGICAS; HawkinsBT; 57(2):173-185 (2005) ]. Estas células endoteliales estrechamente empaquetadas son la barrera hematoencefálica ( BBB ). Más específicamente, la BBB consiste en la membrana de la célula endotelial luminal que mira hacia el torrente sanguíneo, la membrana abluminal.membrana de la célula endotelial frente al líquido intersticial del cerebro, y de 300 a 500 nanómetros de citoplasma endotelial entre estas dos membranas [ NEURORX; Cornford,EM; 2(1):27-43 (2005) ].
Solo el agua, las pequeñas moléculas lipofílicas y las sustancias transportadas activamente cruzan la BBB. Debido a que la glucosa, las vitaminas y muchos aminoácidos solo pueden atravesar las células endoteliales de la BBB mediante transporte activo, las células endoteliales de la BBB tienen de 2 a 4 veces más mitocondrias que otras células endoteliales. Las mitocondrias también ayudan a mantener los gradientes electroquímicos y los complejos de uniones estrechas. Los altos requerimientos de ATP de la BBB la hacen particularmente susceptible a lesiones isquémicas [ AMERICAN JOURNAL OF PHYSIOLOGY; Witt, WA; 285(6):H2830-H2831 (2003) ].
Las uniones estrechas que conectan las células endoteliales cerebrovasculares pueden denominarse el sitio de la BBB. Las proteínas transmembrana claudina y ocludina que se unen a las uniones estrechas están conectadas al citoesqueleto intracelular y otras proteínas. Las células gliales cancerosas ( gliomas ) del cerebro pueden tener una secreción muy aumentada del factor de crecimiento endotelial vascular ( VEGF ), lo que da como resultado una disminución de la síntesis de ocludina y un aumento de la permeabilidad vascular (lo que provoca edema). Se ha demostrado que el tratamiento con glucocorticoides reduce la expresión de VEGF en gliomas malignos [ JOURNAL OF CLINICAL INVESTIGATION; Heiss, JD; 98(6):1400-1408 (1996)]. Dentro de las seis horas posteriores a un accidente cerebrovascular, la hipoxia en la zona limítrofe del área isquémica induce la expresión de VEGF, lo que resulta en edema y revascularización [NATURE; WeisSM; 437:497-503 (2005)].
La BBB proporciona al cerebro un entorno químico que es algo más estable que el entorno químico proporcionado al resto del cuerpo por el torrente sanguíneo, y algo independiente de él. El BBB protege al cerebro de las variaciones de iones, aminoácidos, azúcares, hormonas, etc. en el torrente sanguíneo debido a la dieta, la liberación de hormonas y otros factores. Muchos aminoácidos, como la glicina y el GABA (ácido gamma-aminobutírico), que actúan como neurotransmisores en el cerebro, están fuertemente restringidos por la BBB para evitar la entrada al cerebro. El transporte facultativo de glutamina y glutamato se produce en la membrana luminal, pero no en la abluminal, de la BHE, lo que facilita la eliminación de estos aminoácidos del cerebro [ INFORMES FARMACOLOGICOS; Bernacki,J; 60(5):600-622 (2008)]. La norepinefrina en el torrente sanguíneo secretada por la médula suprarrenal podría afectar significativamente la actividad cerebral, pero esta molécula polar solo cruza lentamente la BBB, y el cerebro está así protegido de las variaciones en los niveles plasmáticos de esa hormona que también actúa como neurotransmisor.
| Astrocito con pies terminales en capilar y neurona |
|---|
 |
Los astrocitos son células gliales cerebrales que tienen procesos de "punta de pie" conectados a neuronas y células endoteliales BBB, que brindan soporte bioquímico. Los procesos de los astrocitos rodean los capilares de la BBB tan completamente que alguna vez se pensó que eran la BBB, aunque ahora se sabe que no lo son. Sin embargo, los astrocitos pueden transmitir señales bioquímicas a las células endoteliales BBB que ayudan a inducir el fenotipo de células endoteliales BBB. Los pericitos también afectan las células endoteliales al inducir una estructura similar a un capilar [ THE FASEB JOURNAL; Ramsauer,M; 16(10):1274-1276 (2002) ] y la regulación del flujo sanguíneo mediante cambios en el diámetro de los capilares [ NATURE; Peppiatt, CM; 443:700-704 (2006) ].
El BBB transporta activamente D-glucosa en lugar de su estereoisómero L-glucosa. El agua cruza la BBB con menos facilidad que otras paredes capilares, lo que protege al cerebro de los cambios en la tonicidad del plasma. La BBB es solo ligeramente permeable a los electrolitos, como el sodio, el potasio y el cloruro, tan impermeable como algunas membranas celulares. Se determinó que el potasio permeaba la BBB a una velocidad de 13,5 x 10 −7 centímetros por segundo, casi diez veces más rápido que el sodio (que permea un poco más rápido que el cloruro) [JOURNAL OF NEUROCHEMISTRY; Smith, O; 46(6):1732-1742 (1986)]. Las moléculas eléctricamente neutras con una masa molecular inferior a 400-500 unidades de masa atómica pueden cruzar la BBB, pero la permeación disminuye exponencialmente a medida que aumenta el tamaño molecular para los átomos no lipofílicos.INTERVENCIONES MOLECULARES; Perdridge, WM; 3(2):90-105 (2003) ]. Las sustancias con más de 8-10 enlaces de hidrógeno muestran un transporte mínimo a través de la BBB [ NEURORX; Perdridge, WM; 2(1):3-14 (2005) ].
El daño isquémico de la BBB permite un mayor paso del crioprotector, aunque la hipotermia dentro de las dos horas de isquemia prolongada protege significativamente a la BBB [ACTA NEUROPATHOLOGICA; Preston,E; 108(5):406-412 (2004)]. El magnesio también puede proteger la BHE [REVISTA DE ANESTESIOLOGÍA NEUROSURGICA; Esen,F; 15(2):119-125 (2003)]. Los crioprotectores suelen tener una alta capacidad de enlace de hidrógeno, pero debido a que son moléculas pequeñas, cruzan (lentamente) la BBB. En los pacientes criónicos, la BBB a menudo se daña por una lesión por reperfusión isquémica . Irónicamente, el crioprotector DMSO es una de varias sustancias (junto con el etanol y los detergentes) que se han utilizado para ayudar en la administración de fármacos mediante la apertura de la BBB [ NEURORX; Perdridge, WM; 2(1):3-14 (2005) ]. los capsaicina fitoquímica [ BRITISH JOURNAL OF PHARMACOLOGY; Hu,D; 146(4):576-584 (2005) ] y el agente de contraste Optison [ ANESTHESIA & ANALGESIA; Mychaskiw,G; 91(4):798-803 (2000) ] también se han utilizado para interrumpir el BBB.
Aunque el protocolo actual de criónica logra suficiente saturación del cerebro con crioprotectores, la permeación es incompleta, el cerebro se encoge y parte de la vitrificación se logra mediante la deshidratación y las proteínas intracelulares. Encontrar formas de abrir la barrera hematoencefálica para permitir una mayor saturación de crioprotectores vitrificantes sin causar edema podría ser un medio para aumentar la viabilidad cerebral final, siempre que la toxicidad de los crioprotectores sea menos dañina que los efectos de la deshidratación.
IX. EDEMA EN CRIONICS
| Edema en la pierna derecha |
|---|
 |
El edema es la inflamación de los tejidos del cuerpo debido al exceso de líquido dentro de las células y/o en el líquido intersticial. El edema es un problema frecuente que impide o limita la perfusión de los pacientes criónicos. Los pacientes muestran con mayor frecuencia una cabeza hinchada e hinchada o un abdomen hinchado. El líquido tisular comprime los vasos sanguíneos impidiendo el flujo de perfusión. Como se describe en la sección II , la isquemia priva de energía a la bomba de sodio, lo que hace que las células se hinchen debido a la entrada excesiva de iones de sodio (que transportan agua adicional a las células). Lesión por isquemia y reperfusiónpuede aumentar la permeabilidad capilar y, por lo tanto, aumentar el líquido intersticial. Muchos pacientes de cryonics han tenido enfermedades que aumentan su susceptibilidad al edema. Las condiciones inflamatorias, por ejemplo, liberan histamina, lo que aumenta la permeabilidad capilar.
Se han descrito cuatro categorías de edema cerebral: (1) vasogénico (2) citotóxico (3) osmótico y (4) intersticial. El edema vasogénico es un edema atribuido a la ruptura de la BHE. El edema citotóxico es el edema debido a la inflamación de las células. El edema osmótico se atribuye a agentes osmóticamente activos, en particular AVP (hormona antidiurética). Edema intersticial se debe a la exudación de líquido cefalorraquídeo de los ventrículos del cerebro. El edema intersticial es la forma menos frecuente de edema cerebral en medicina y criónica. El término edema intersticial también es el menos apropiado porque todo edema que no es citotóxico se asocia con acumulación de líquido en el espacio intersticial. El edema osmótico es el tercero en importancia para la medicina y un distante tercero en criónica en comparación con el edema cerebral vasogénico y citotóxico. El edema citotóxico precede al edema vasogénico en víctimas de accidentes cerebrovasculares [ACTA NEUROPATHOLOGICA; Albayrak,S; 94(2):158-163 (1997)].
La sensibilidad de la BBB rica en mitocondrias a la hipoxia, y el aumento de la permeabilidad resultante de la hipoxia, se evidencia por el hecho de que se observa edema cerebral en el mal de altura [ STROKE; Osta, AV; 36(3):557-560 (2005) ]. La presión capilar alta o (más a menudo) la conmoción cerebral son causas frecuentes de edema cerebral en la medicina convencional. La fuga de líquido al cerebro comprime los vasos sanguíneos, lo que reduce el flujo sanguíneo y aumenta la presión, lo que da como resultado un círculo vicioso. La reducción de oxígeno daña los capilares y reduce la actividad de la bomba de sodio, lo que provoca la inflamación de las células, otro ciclo vicioso. Cuando el flujo sanguíneo cerebral cae por debajo de 10-15 mililitros por cada 100 gramos de tejido cerebral, la materia gris comienza a absorber agua incluso antes de que se interrumpa la BHE [RADIOLOGÍA; Dzialowsky,I; 243(3):720-726 (2007) ].
De cuatro a seis horas de isquemia cerebral conduce a una ruptura de la BBB, pero en las primeras horas de la isquemia, el transporte activo de sodio (junto con cloruro y agua) hacia el cerebro es inducido por hipoxia, particularmente en la membrana luminal, lo que inicialmente causa problemas cerebrales. edema, y más tarde causando hinchazón de las células endoteliales BBB [ AMERICAN JOURNAL OF FISIOLOGÍA; Brillault, J; 294(1):C88-C96 (2008) ]. La reperfusión dentro de una hora de isquemia normotérmica en una víctima de accidente cerebrovascular puede prevenir el daño a la BHE, pero la reperfusión después de más de dos horas invariablemente conduce a edema vasogénico en uno o dos días [ ACV; Neumann-Haefelin, T; 31(8):1965-1973 (2000)]. Clínicamente, las víctimas de accidentes cerebrovasculares suelen tardar de 2 a 5 días en manifestar edema [JOURNAL OF CLINICAL NEUROSCIENCE; Ayata,C; 9(2):113-124 (2002)]. La lisis de los eritrocitos puede contribuir significativamente al edema vasogénico, al menos en parte porque el hierro procedente de la descomposición de la hemoglobina es un potente catalizador de la peroxidación de lípidos [ STROKE; Xi,G; 32(12):2932-2938 (2001) ]. Los radicales libres de superóxido generados por la NADPH oxidasa también parecen ser un contribuyente principal a la interrupción de la BBB en la isquemia/reperfusión [ STROKE; Kahles,T; 38(11):3000-3006 (2007) ]. La eliminación de células sanguíneas (leucocitos y eritrocitos) puede proteger contra la lesión por reperfusión subsiguiente [ ACV; Sucio; 33(10):2492-2498 (2002) ].
El edema citotóxico en el cerebro se debe principalmente a los astrocitos y las dendritas más que a los cuerpos celulares neuronales [JOURNAL OF NEUROPATHOLOGY AND EXPERIMENTAL NEUROLOGY; Rosenblum, WI; 66(9):771-778 (2007)]. La inflamación de las células puede deberse a la capacidad reducida de las células sin energía para bombear iones de sodio (Na + ), aunque existen otros mecanismos para la inflamación de los astrocitos en el edema cerebral [ GLIA; Kimbelberg, Hong Kong; 50(4):389-397 (2005) ]. Los iones de sodio atraen las moléculas de agua con más fuerza que los iones de potasio, por lo que cuando los iones de sodio ingresan a las células, traen consigo más agua. Si el sodio es capaz de atravesar una BHE dañada isquímicamente, podría ingresar a las células cerebrales con deficiencia de ATP y causar inflamación citotóxica. Según los informes, el edema citotóxico reduce el flujo sanguíneo mucho más que el edema vasogénico.CARRERA; Hossman, KA; 12(2):211-217 (1981) ]. Incluso si el sodio no cruza la BBB, puede causar inflamación de las células endoteliales deficientes en ATP y, por lo tanto, reducir el flujo capilar en el cerebro. Se esperaría que todos los pacientes de criónica, incluso aquellos que han recibido una estabilización rápida después del pronunciamiento de la muerte, hayan experimentado edema citotóxico. Cuando la BBB está intacta, el estrechamiento de los capilares cerebrales debido a la inflamación de las células endoteliales puede rectificarse con una solución salina hipoosmótica/dextrano [CHOQUE CIRCULATORIO; Mazzoni, MC; 31(4):407-418 (1990)]. Se ha demostrado que una hipotermia leve (2ºC) previene el edema citotóxico resultante de una disminución moderada del flujo sanguíneo cerebral en ratas [ ACTA NEUROBIOLOGIAE EXPERIMENTALIS; Schwab,M; 58(1):29-35 (1998) ].
El ATP celular disminuye rápidamente con la isquemia, y hay suficiente sodio en el espacio extracelular para causar inflamación celular. La inflamación celular por sí sola no causa edema cerebral porque el agua cerebral, el Na + y el Cl− simplemente se desplazan hacia las células desde el espacio extracelular hacia las células. Pero el desplazamiento de estas moléculas desde el espacio extracelular crea un gradiente para atraerlas a través de la BHE hacia el cerebro, lo que da como resultado una inflamación del cerebro [ LANCET NEUROLOGY; Simard,JM; 6(3):258-268 (2007) ]. La solución salina hipertónica podría aumentar este problema, aunque eso no está probado.
Los agujeros de trepanación se utilizan en medicina para reducir el posible daño cerebral causado por la presión intracraneal (PIC) alta que resulta de un hematoma subdural , siendo el drenaje continuo más efectivo que el drenaje único [ MONITOR DE CIENCIA MÉDICA; Kiymaz,N; 13(5):CR240-CR243 (2007) ]. Las pinturas rupestres y los cráneos prehistóricos indican que perforar o raspar un agujero en el cráneo para aliviar la presión del sangrado asociado con los golpes en la cabeza puede haber sido el procedimiento quirúrgico más antiguo del que existe evidencia. La PIC que excede de 40 mmHg a 50 mmHg puede apretar los vasos sanguíneos y reducir la perfusión cerebral, lo que lleva a la pérdida del conocimiento. Los agujeros de rebaba pueden proteger a un paciente de criónica de la PIC que daña el cerebro debido al edema durante la perfusión.
El alcohol azúcar manitol se usa con frecuencia en criónica y farmacología debido a su tamaño y propiedades. Así como la glucosa se puede reducir al alcohol de azúcar sorbitol , la fructosa se puede reducir al alcohol de azúcar manitol . El sorbitol y el manitol se han utilizado como edulcorantes artificiales porque se absorben mínimamente en el intestino. Incluso cuando se absorbe el sorbitol, proporciona solo dos tercios de las calorías de la glucosa.
| Reducción de glucosa a sorbitol | Fructosa | manitol |
|---|---|---|
 |  |  |
Debido a que el manitol no cruza la BBB, se ha utilizado en criónica para prevenir el edema cerebral. El manitol puede atravesar las membranas capilares en otras partes del cuerpo, pero no en el cerebro. Así, el manitol es un agente oncótico para el cerebro, pero no para el resto del cuerpo. ( El manitol es la M de MHP −2 , que la organización de criónica Alcor ha utilizado como solución para la preservación de órganos). El aumento de la osmolalidad del plasma de 310 mOsm/kgH 2 O a 344 mOsm/kgH 2 O puede reducir el tamaño del cerebro en 10 %, con la mitad de la contracción ocurriendo en 12 minutos.
Se ha utilizado manitol hiperosmótico (1,5 molar) para abrir temporalmente la BHE, lo que permite la administración del fármaco. La perfusión de manitol en la arteria carótida contrae las células endoteliales de los capilares, lo que ensancha las uniones estrechas entre las células durante varias horas [ AMERICAN JOURNAL OF FISIOLOGÍA; Informe, SI; 238(5):R421-R431 (1980) ]. En un experimento con ratas, una solución de manitol al 25 % infundida en la arteria carótida durante 30 segundos a una velocidad de 0,25 mililitros/kilogramo/segundo incrementó cinco veces la transferencia BBB de ácido α-aminoisobutírico [ JOURNAL OF CEREBRAL BLOOD FLOW & METABOLISM; Chi,OZ; 16(2):327-333 (1996) ].
Históricamente, el manitol ha sido el agente de elección para el tratamiento hiperosmótico del edema cerebral en medicina, pero ha habido una tendencia creciente hacia el uso de solución salina hipertónica, que reduce la adherencia de los neutrófilos a las células endoteliales [ ANNALS OF SURGERY; Pascual,JL; 236(5):634-642 (2002) ]. El manitol, por otro lado, reduce la viscosidad de la sangre [NEUROLOGÍA QUIRÚRGICA; Andrews,RJ; 39(3):218-222 (1993)] y daño oxidativo [BRAIN RESEARCH; 1164:132-135 (2007)]. Sin embargo, para propósitos de criónica, el manitol tiene la desventaja de una solubilidad reducida a temperaturas más bajas.
A los agentes utilizados para el tratamiento hiperosmolar del edema vasogénico se les asignan coeficientes de reflexióncomo una medida de la medida en que se reflejan, en lugar de pasar a través de la BBB. Al cloruro de sodio se le asigna un coeficiente de reflexión de 1,0 para indicar que no cruza la BBB en absoluto, sino que se "refleja" por completo. El manitol se refleja en un 90 % y, por lo tanto, tiene un coeficiente de reflexión de 0,9. El glicerol, con un coeficiente de reflexión de aproximadamente 0,5, presenta el mayor peligro de que, si se usa para un tratamiento hiperosmótico médico prolongado, cruce la BBB y comience a retener agua dentro del cerebro [JOURNAL OF NEUROLOGICAL SCIENCE; Ziai, WC; 261(1-2):157-166 (2007)]. Las concentraciones de glicerol superiores al 20% pueden causar hemólisis [ACTA NEUROCHIRUGICA; Biestro,A; 139(8):725-733 (1997)]. Un bolo inicial de manitol deshidrata transitoriamente el cerebro, pero las dosis repetidas exacerban el edema [JOURNAL OF NEUROSURGERY; Kaufmann, AM; 77(4):584-589 (1992)]. La BHE expulsa activamente sodio, por lo que tiene menos potencial para un efecto de rebote que el manitol en pacientes metabólicamente activos (en lugar de pacientes con criónica isquémica) [JOURNAL OF NEUROSURGICAL ANAESTESIOLOGY; Qureshi,AI; 10(3):188-192 (1998)].
| Reducción de la PIC con solución salina hipertónica y manitol |
|---|
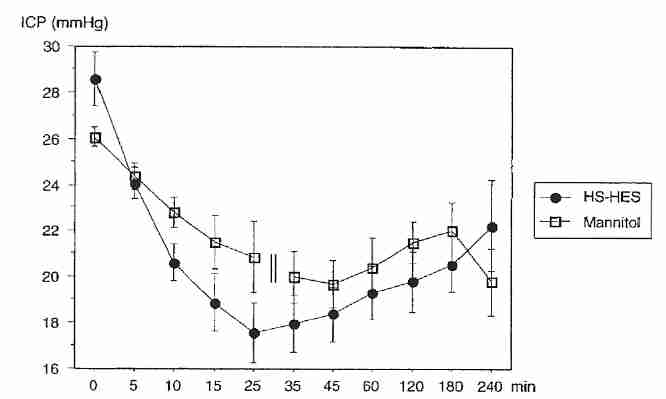 |
Los experimentos con ratas con solución salina hipertónica equimolar (7,5 %) o manitol (20 %) utilizados para el tratamiento hipertónico del accidente cerebrovascular experimental han demostrado generalmente que la solución salina hipertónica es superior para reducir el contenido de agua en el cerebro [CRITICAL CARE MEDICINE; Toung,TJ; 33(1):203-208 (2005)]. Se han observado resultados similares con ensayos clínicos que comparan la presión intracraneal ( PIC ) en pacientes humanos con accidente cerebrovascular tratados con solución salina hipertónica equimolar (7,5 %) o manitol (20 %) [ANESTESIOLOGÍA; Roset, I; 107(5):697-704 (2007) y STROKE; Schwarz,S; 29(8):1550-1555 (1998) ]. Aunque el manitol al 20 % y la solución salina al 7,5 % son equimolares , el manitol al 20 % es equismolar con la solución salina al 3,6 %.
El uso de soluciones equimolares de manitol y solución salina permite una buena comparación directa, pero no responde a la pregunta de cuál sería la concentración óptima de manitol o solución salina. Y lo que es óptimo para la medicina podría no serlo para la criónica. En medicina, se tiene cuidado para prevenir la hemólisis, pero esto podría no ser tan preocupante para la criónica en la medida en que la sangre se lave. La contracción de los glóbulos rojos por deshidratación hipertónica puede ser beneficiosa para ayudar a eliminar las células, excepto por el hecho de que los glóbulos rojos deshidratados tienen una mayor adhesión a las paredes de los vasos sanguíneos [BRITISH JOURNAL OF HEMATOLOGY; Wandersee, Nueva Jersey; 131(3):366-377 (2005)].
Otra posible complicación es el hecho de que el manitol se usa clínicamente para abrir la BHE y permitir que los medicamentos ingresen al cerebro [CANCER TREATMENT REVIEWS; Kemper, EM; 30(5):415-423 (2004)]. La entrada de agua en el cerebro después de la apertura de la BBB por el manitol es deseable para la absorción de fármacos, pero solo sería deseable en criónica si se mejorara la absorción de crioprotectores, pero el objetivo es reemplazar el agua por crioprotectores. Cinco minutos de manitol 1,6 molar es suficiente para abrir el BBB [PROTOCOLOS DE INVESTIGACIÓN CEREBRAL; Bhattacharijee, Ak; 8(2):126-131 (2001)], pero el manitol 1,1 molar es adecuado a 4ºC porque la hipotermia ayuda al manitol a abrir la BHE [COMUNICACIONES DE INVESTIGACIÓN BIOQUÍMICA Y BIOFÍSICA; Ikeda,M; 291(3):669-674 (2002)]. No obstante, el manitol es poco soluble en agua: el manitol 1,66 molar puede precipitar a 37ºC, razón por la cual se ha utilizado en su lugar el azúcar más soluble arabinosa [AMERICAN JOURNAL OF FISIOLOGÍA; Informe, SI; 239(5):R421-R431 (1980)].
21st Century Medicine ( 21CM ) ha examinado sistemáticamente moléculas para inhibir la inflamación celular y ha encontrado que la alfa lactosa es especialmente eficaz . 21CM patentó una solución de preservación de órganos que llaman TranSend, que se basa en alfa lactosa y poliglicerol. No se menciona si la alfa lactosa cruza la BBB. Aunque la lactosa es menos costosa que el manitol, tiene una masa molar mayor (342 frente a 182 para el manitol) y, por lo tanto, se esperaría que fuera menos eficaz como agente osmótico y más viscoso por gramo. En la medida en que el manitol no cruce la BBB, reducirá la inflamación de las células en el cerebro simplemente deshidratando el cerebro. Por lo tanto, el manitol es a menudo el agente de elección para el lavado de sangre hiperosmótica en criónica, aunque sus características de baja solubilidad (especialmente a baja temperatura) pueden presentar problemas.
(Para obtener más información sobre el daño por isquemia/reperfusión en la barrera hematoencefálica, consulte Lesión por reperfusión y "Sin reflujo" .)
El dextrano es un polisacárido de glucosa con una masa molecular designada en kilodaltons , por ejemplo, el dextrano-60 tiene un peso molecular de 60 000 (60 kilodaltons). (El plasma contiene alrededor de 4-5% de albúmina, y la albúmina tiene un peso molecular de alrededor de 65 000). El dextrano reduce la adherencia de los leucocitos y las plaquetas a las células endoteliales durante la reperfusión, con pesos moleculares cada vez mayores que reducen cada vez más la adherencia [AMERICAN JOURNAL OF PHYSIOLOGY; Steinbauer,M; 272 (4 Pt 2): H1710-H1716 (1997)]. Los dextranos también mejoran la fibinólisis [MEDICINA DE CUIDADOS CRÍTICOS; de Jonge,E; 29(6):1261-1267 (2001)].
El flujo capilar después de un shock hemorrágico puede verse obstaculizado por la inflamación de las células endoteliales (un tipo de edema citotóxico). Se ha demostrado que una mezcla de NaCl al 7,2 % y dextrano-60 al 10 % reduce significativamente la hinchazón de las células endoteliales después de un shock hemorrágico [JOURNAL OF SURGICAL RESEARCH; Corso,CO; 80(2):210-220 (1998)]. Una solución de NaCl al 7,2 %/dextrano 60 al 10 % es hiperosmótica e hiperoncótica en relación con el plasma. Los capilares estrechados pueden estar obstruidos por leucocitos, lo que lleva a que "no haya reflujo" en la reperfusión, rectificado por solución hiperosmótica/hiperoncótica de NaCl/dextrano [CHOQUE CIRCULATORIO; Mazzoni, MC; 31(4):407-418 (1990)]. La alta viscosidad del líquido de resucitación puede ser más importante que ser hiperoncótico [SHOCK; Cabrales,P; 22(5):431-437 (2004)].
La BHE se vuelve cada vez más permeable con isquemia progresiva/tiempo de reperfusión (edema vasogénico), pero se pueden usar dextranos cada vez más grandes para mantener la presión oncótica [MICROCIRCULACIÓN; Nagaraja, Tennessee; 15(1):1-15 (2008)]. Pero incluso más allá del punto en que los dextranos grandes comienzan a filtrarse a través de la BBB (21 horas después de un episodio isquémico de 3 horas) y ya no son capaces de mantener la presión oncótica, pueden beneficiar la perfusión en un paciente con criogenia isquémica al eliminar los leucocitos y las plaquetas de la sangre. vasos
 diciembre 16, 2022
diciembre 16, 2022
 Posted in:
Posted in: 
