CONTENIDOS: ENLACES A SECCIONES
I. OBSERVACIONES INTRODUCTORIAS
Con el uso de crioprotectores adecuados (compuestos "anticongelantes") en pacientes con criónica , el daño por cristales de hielo puede eliminarse virtualmente. (Las estimaciones para neuropacientes criónicos vitrificados recientes están en el rango de 0,2% de agua que se convierte en hielo). Cuando los tejidos biológicos se vitrifican, en lugar de congelarse, se endurecen lentamente como el vidrio, y el endurecimiento solo se completa en el rango de −130ºC. A temperaturas tan bajas, la viscosidad es alta y el daño debido a la movilidad molecular es bajo. El daño por radiación también se minimiza, porque la mayoría de los efectos dañinos de la radiación ionizante se deben a la movilidad de los átomos o moléculas de radicales libres [ ULTRAMICROSCOPIA; Knopek,E; 10(1-2):71-86 (1982)]. Pero, ¿pueden cuantificarse la movilidad y los daños de tal manera que puedan estimarse los efectos a lo largo de décadas o siglos?
La movilidad molecular de las muestras biológicas se puede analizar indirectamente a temperatura de hielo seco (alrededor de −80 ºC) sobre la base de la pérdida de viabilidad con el tiempo. Las plaquetas humanas se pueden almacenar a temperatura de hielo seco hasta por dos años sin pérdida de calidad [VOX SANGUINIS; Melaragno,AJ; 49(4):245-258 (1985)]. Los glóbulos rojos almacenados a temperatura de hielo seco durante 18 años en glicerol han mostrado tasas de rotura del 6,7 % si se transportan y del 2,4 % si no se transportan [TRANSFUSIÓN; Valeri, CR; 45(5):822-823 (2005)]. El esperma de ratón almacenado a temperatura de hielo seco durante 4 meses en una solución de criopreservación de rafinosa mostró solo un poco menos de fertilidad (71 %) que el esperma de ratón almacenado a temperatura de nitrógeno líquido durante 8 meses (73 %), pero el esperma de ratón almacenado durante 8 meses en hielo seco temperatura mostró significativamente menos fertilidad (51%) [ANIMALES DE EXPERIMENTACION; Okamoto,M; 50(1):83-86 (2001) ]. Los estudios bioquímicos de cortes de hígado de rata de 3 a 4 milímetros de espesor mostraron solo una ligera disminución en la actividad enzimática después de dos semanas de almacenamiento a temperatura de hielo seco [HISTOQUÍMICA Y BIOLOGÍA CELULAR; Prento,P; 108(6):543-547 (1997)].
El criobiólogo Peter Mazur ha declarado que por debajo de los −130ºC "... la viscosidad es tan alta (>10 13 Poise) que la difusión es insignificante en períodos de tiempo inferiores a los geológicos". Añade que "... no hay ningún caso confirmado de muerte celular atribuido al almacenamiento a -196 ºC durante unos 2-15 años y ninguno incluso cuando las células están expuestas a niveles de radiación ionizante unas 100 veces superiores durante hasta 5 años". [REVISTA AMERICANA DE FISIOLOGÍA; Mazur,P; 247 (3 Pt 1): C125-C142 (1984)]. Embriones de ratón congelados de 8 células sometidos al equivalente de 2000 años de rayos gamma de fondo durante 5 a 8 meses en nitrógeno líquido no mostraron ningún efecto perjudicial sobre la supervivencia o el desarrollo [ JOURNAL OF REPRODUCTION AND FERTILITY; Glenister, PH; 70(1):229-234 (1984) ].
Estas afirmaciones son tranquilizadoras, pero sería interesante saber cuáles son las movilidades moleculares exactas en un sólido vitrificado o en un paciente de criónica humano semivitrificado. Lo que puede ser una difusión "insignificante" para los propósitos de Mazur puede tener un impacto significativo en los casos de criónica. La pérdida de información es posible en una célula que, sin embargo, sobrevive. Tener una idea de qué tan lejos, en relación con otras moléculas, una molécula de agua podría moverse a estas temperaturas podría dar una idea de cuánta "mezcla" y "disolución" es posible durante un período de 100 años.
Para un gas ideal, la temperatura se puede expresar como velocidad molecular, pero para un líquido o sólido, la unión entre moléculas o átomos afectará significativamente la movilidad molecular a bajas temperaturas. Parecería que la viscosidad estaría en proporción directa con la movilidad molecular, pero no existe una fórmula simple para expresar la velocidad de las moléculas en un sólido con una viscosidad de 10 13 Poise.
II. ENLACES DE HIDRÓGENO
El enlace de hidrógeno en el hielo no es el mismo que se ve en el agua. [Ver ENLACE DE HIDRÓGENO por S. Vinogradov & R. Linnel (1971) Sección 1-1, y Felix Franks Capítulos 3 y 4]. Las entalpías de enlace H en el hielo I varían de 4,7 a 8,2 kcal/mol, mientras que las entalpías de enlace H en el agua varían de 1,3 a 2,8 kcal/mol. Un enlace H del agua tiene una vida media de aproximadamente 2x10 −13 segundos. A 0ºCelcius, las moléculas de agua experimentan 10 11 a 10 12 movimientos de reorientación y traslación por segundo, mientras que las moléculas de hielo a la misma temperatura experimentan 10 5 a 10 6 movimientos de reorientación y traslación por segundo. Sin embargo, los enlaces de hidrógeno tetraédricos en una red de cristales de hielo son casi tan fuertes como los enlaces covalentes, en contraste con la red aleatoria de enlaces de hidrógeno flexibles e intercambiables que se encuentran en el agua líquida. Una solución de etanol tiene incluso más enlaces de hidrógeno que el agua (98 %) pero sigue siendo fluida. Se esperaría que las moléculas en el sólido semi-vitrificado de un paciente criónico (hielo, glicerol/agua, sales, proteína, grasa) tuvieran más movilidad que las moléculas en un cristal de hielo, en particular las moléculas de agua que son motivo de preocupación debido a su posible papel en la disolución y la hidrólisis. Las moléculas en un paciente de criónica totalmente vitrificado (<0,2 % de hielo) (crioprotector sin glicerol) tendrían algo más de movilidad.
A 135 Kelvin (−138º Celcius) el agua vitrificada tiene una energía vibratoria de 17,91 KJoule/mol y una energía de flexión de 1,93 KJoule/mol a diferencia del hielo I que tiene 18,55 y 0 KJoule/mol, respectivamente. Parece razonable que la diferencia de movimiento de traslación entre un cristal y un sólido vítreo a la temperatura del nitrógeno líquido sea probablemente inferior a un orden de magnitud.
tercero ECUACIONES DE DIFUSIÓN
Sería bueno tener herramientas analíticas con las que cuantificar los posibles daños, y el conocimiento de la movilidad molecular a 143 K, 77 K y 4,2 K sería un paso en la dirección correcta. Las leyes de difusión para líquidos parecen ser buenos modelos para sistemas vitrificados en la medida en que una sustancia vítrea a baja temperatura puede considerarse como un líquido altamente viscoso. Sin embargo, la Primera Ley de Fick para la difusión no sería apropiada:
dc
J = − DA ----
dx
J = velocidad de difusión (moles/tiempo)
D = Coeficiente de difusión = Difusividad de masa
A = Área a través de la cual se produce la difusión
dc/dx = gradiente de concentración (diferencia de concentración dividida por la distancia)
La primera ley de Fick establece que la velocidad de difusión a lo largo de un gradiente de concentración es proporcional a la magnitud instantánea del gradiente de concentración (que cambia a medida que avanza la difusión). Para el movimiento de moléculas de una región de mayor concentración a una región de menor concentración, dc/dx será negativo, por lo que multiplicar por −DA da un valor positivo a J. La difusión en un paciente de criónica vitrificada presumiblemente no se debe a gradientes de concentración porque no debe haber gradientes de concentración. Además, la Primera Ley de Fick depende de conocer un coeficiente de difusión, que se aproxima a lo que estamos tratando de determinar. El coeficiente de difusión es mayor para temperaturas más altas y para moléculas más pequeñas.
La ecuación de Einstein-Stokes es una fórmula para el cálculo de la difusividad browniana , donde la difusividad varía directamente con la temperatura absoluta y varía inversamente con la viscosidad y el radio molecular:
kT
D = -----
6πrµ
D = Difusividad browniana
k = Constante de Boltzmann
T = Temperatura absoluta (Kelvins)
r = Radio de la molécula
π = 3.14159265358979323... (pi)
µ = Viscosidad del medio
Radius es particularmente revelador porque la fórmula está destinada a ser aplicable a moléculas esféricas grandes. Por supuesto, en un paciente de criónica vitrificada hay una mezcla muy heterogénea de moléculas, muchas de las cuales son bastante grandes o forman barreras de membrana (barreras de agua y aceite o bloqueo de moléculas grandes).
En última instancia, tendría que determinarse empíricamente una estimación de alta precisión de la movilidad molecular en un paciente de criónica. Sin embargo, desde el punto de vista analítico, para una temperatura dada, el límite inferior de la movilidad molecular podría ser el de un cristal de hielo (quizás no sea útil, ya que esta movilidad sería cercana a cero) y el límite superior podría ser el dictado por la ecuación de Einstein-Stokes utilizando la viscosidad y diámetro medio de una molécula crioprotectora.
Una vez que se estima o determina empíricamente una tasa de difusión, los únicos "pequeños problemas" que quedan son determinar cuánto tiempo se espera que un paciente de criónica se almacene antes de la reanimación y cuantificar cuán dañina sería la movilidad molecular determinada a esa temperatura.
IV. VISCOSIDAD Y TRANSICIÓN VIDRIO
Con la vitrificación, un líquido se convierte en vidrio, con una ralentización espectacular del movimiento de difusión de las moléculas y una aparente pérdida de la capacidad de fluir. Pero la estructura molecular líquida se conserva. El movimiento de traslación y rotación de las moléculas cesa nominalmente a la temperatura de transición vítrea ( Tg ), dejando sólo el movimiento vibratorio para la energía térmica. Un "modelo de empuje", sin embargo, sostiene que algo de flujo ocurre dentro de los vidrios por medio de fluctuaciones térmicas poco frecuentes que logran una energía de activación suficiente para "empujar a un lado" las moléculas adyacentes y causar un evento de flujo local [ QUINTA REUNIÓN INTERNACIONAL DE DISCUSIÓN SOBRE RELAJACIÓN EN COMPLEJO SISTEMAS; Dyre,JC; julio de 2005)]. En un vidrio, así como en un líquido viscoso, una tensión local se alivia por difusión, un proceso descrito a nivel molecular como relajación estructural . La difusión puede ocurrir cuando hay suficiente energía local para superar la "fricción molecular". Las ecuaciones de "salto de difusión" suelen ser mejores que la ecuación de Einstein-Stokes para determinar la difusividad en líquidos viscosos cerca de T g . El alivio de las tensiones locales mediante la elevación intencional de la temperatura (para acortar el tiempo de relajación estructural) se denomina recocido . El alivio natural de las tensiones locales debido a la difusión a lo largo del tiempo se denomina envejecimiento .
Para líquidos sobreenfriados o sistemas amorfos (vítreos), el tiempo de relajación describe la rapidez con la que el sistema vuelve a ser un líquido o vidrio sobreenfriado en equilibrio cuando se somete a una tensión local. Aunque un líquido o vidrio viscoso sobreenfriado puede describirse como "metaestable" (o fuera de equilibrio) por no ser cristalino, el líquido o vidrio también puede describirse como "relativamente fuera de equilibrio" cuando se somete a una estrés local. En este sentido, la relajación estructural y el tiempo de relajación se pueden aplicar a vidrios y líquidos sobreenfriados de la misma manera que se aplicarían a cualquier líquido viscoso por encima de su punto de fusión.
La movilidad molecular disminuye al aumentar la viscosidad. O dicho de otro modo, la movilidad molecular es el recíproco de la viscosidad. Para los agentes formadores de vidrio hay un aumento significativo en la viscosidad asociado con la temperatura de transición vítrea ( Tg ). Para los crioprotectores, como los que se utilizan en la criónica, los enlaces de hidrógeno son la principal limitación del movimiento molecular. Las sustancias crioprotectoras con una T g más alta (generalmente aquellas con un peso molecular más alto) tienen enlaces de hidrógeno que son más largos y más débiles que los de las sustancias con una T g más baja ; la movilidad de traslación y rotación molecular se reduce de manera demostrable a la T g [INVESTIGACIÓN SOBRE CARBOHIDRATOS; Trabajadores, WF; 339(6):1077-1085 (2004)].
Las semillas de guisantes que pueden germinar después de 3 a 50 años a 20 ºC pueden sobrevivir de 250 a 2466 años a 0 ºC — efecto debido a las diferencias en la movilidad molecular en el citoplasma vitrificado [ ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE.UU.); Bultink,J; 97(5):2385-2390 (2000) ]. Si la vitrificación pudiera reducir la movilidad molecular a la de un estado cristalino, la energía térmica residual estaría restringida únicamente al movimiento vibratorio, que es mucho menos capaz de dañar las estructuras moleculares (y de desvitrificar ) que el movimiento de rotación y traslación. Los vidrios no tienen por qué fluir y, de hecho, es una leyenda urbana que el vidrio fluyó en los cristales de las ventanas antiguas .
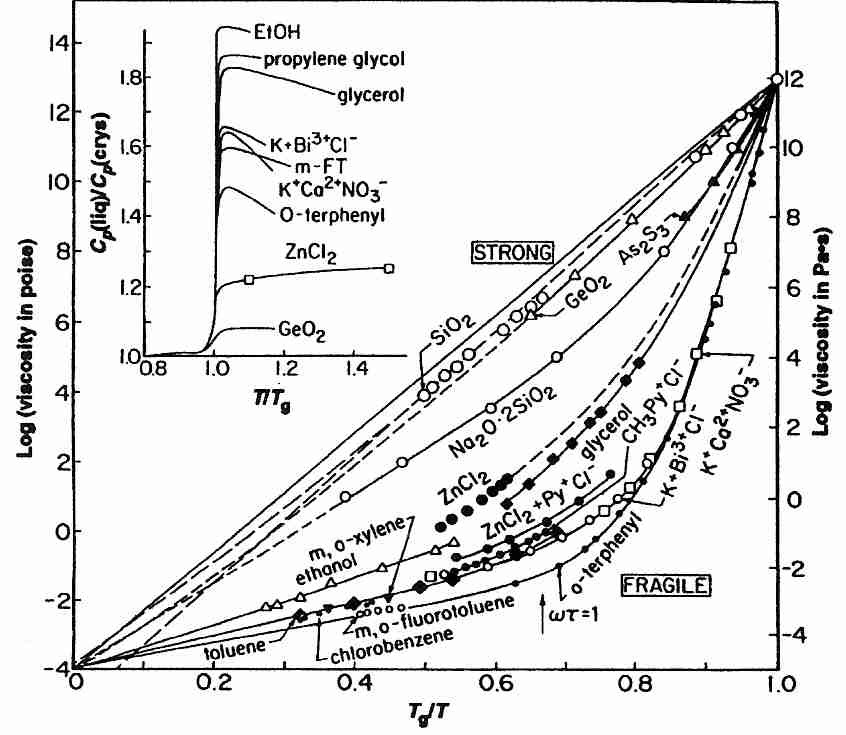 |
Los líquidos vitrificantes se han clasificado como "fuertes" o "frágiles". El término frágil es confuso porque no se refiere a la tendencia a romperse bajo tensión mecánica, sino a un aumento muy rápido de la viscosidad a medida que la temperatura se acerca a T g desde arriba. Las sustancias que se denominan frágiles tienden a tener más tipos de enlaces iónicos (o enlaces de hidrógeno), mientras que las sustancias que son fuertes (y muestran una modesta disminución de la viscosidad por encima de Tg ) tienen más enlaces covalentes. La "fuerza de agarre" cambia más radicalmente para el enlace iónico cerca de Tg . Los enlaces covalentes son más fuertes.(menos frágiles), y los grupos de moléculas que se mantienen unidas por enlaces covalentes son menos susceptibles a los cambios de fase molecular justo por encima de la Tg . Los crioprotectores de tipo glicerol (que se unen principalmente por enlaces de hidrógeno) son más "frágiles" que la sílice vítrea (que tiene coherencia covalente), pero son menos "frágiles" que las sustancias iónicas.
Una mezcla de sales anhidras fundidas de KNO 3 y Ca(NO 3 ) 2 en proporción molar 3:2 ( KNC — K + Ca +2 NO 3 − ) es un líquido extremadamente frágil (como se puede ver en el diagrama). En general, los líquidos muy frágiles (como KNC) tienden a tener un cambio de capacidad calorífica alto en Tg , pero los líquidos con enlaces de hidrógeno (como los crioprotectores) tienen un cambio de capacidad calorífica más alto en Tg , pero solo son moderadamente frágiles (ver recuadro del diagrama).
En la escala de temperatura Kelvin, es una regla general que T g se produce en aproximadamente dos tercios del valor de la temperatura de fusión ( T m ). Las sustancias para las que T g /T m es significativamente superior a 2/3 son frágiles [THERMOCHIMICA ACTA; Hancock, BC; 380:95-107 (2001)].
El carácter lineal de los formadores de vidrio fuertes vistos en una gráfica logarítmica de la viscosidad ( η ) frente al recíproco de la temperatura ( 1/T ) demuestra el comportamiento de una ecuación de Arrhenius, con la viscosidad en lugar de la velocidad de reacción ( k ) como el término de la derecha:
k = A exp [−E a /RT] (Ecuación de Arrhenius)
donde k es la velocidad de reacción, A es una constante, exp indica que el término entre corchetes es una potencia de e (2,71828), E a es la energía de activación, R es la constante universal de los gases y T es la temperatura. Una ecuación en la que la viscosidad ( η ) toma el lugar de la velocidad de reacción es apropiada para formadores de vidrio fuertes (en lugar de frágiles), para los cuales la movilidad molecular disminuye exponencialmente con la temperatura.
Para los formadores de vidrio frágiles (como los crioprotectores utilizados en la criónica) existe una relación exponencial casi doble entre la viscosidad y la temperatura. Para los formadores de vidrio frágiles, la gráfica de la viscosidad frente al recíproco de la temperatura por encima de Tg se ajusta con mayor frecuencia a la ecuación empírica de Vogel-Fulcher-Tammann ( VFT ):
η = A exp [DT o /(TT o )]
donde A es una constante, exp indica que el término entre corchetes es una potencia de e (2.71828), T o es la temperatura a la cual la movilidad molecular es cero (la temperatura VFT, donde la viscosidad se vuelve infinita cuando T = T o ), y D es una constante correspondiente a la fragilidad. Los valores crecientes de D cambian la solución de frágil a fuerte, por lo que la fragilidad se ha definido como el inverso de D. En la práctica, sin embargo, las soluciones reales rara vez se ajustan a la ecuación VFT en un rango completo de valores [ REVISIONES QUÍMICAS; Ángell, CA; 102:2627-2650 (2002)]. Los líquidos más frágiles (como KNC) se ajustan mal a la curva VFT, mientras que los líquidos moderadamente frágiles (como el glicerol) se ajustan muy bien a la curva. La relación T o /T g también se ha utilizado como parámetro de escala para la desviación del comportamiento de Arrhenius, para una relación entre 0 (fuerte) y 1 (frágil) [DIARIO DE SÓLIDOS NO CRISTALINOS; Hodge, IM; 202:164-172 (1996)].
El tiempo de relajación del esfuerzo cortante ( τ s ) a menudo se calcula a partir de la viscosidad ( η ) mediante la ecuación de Maxwell:
η = GRAMO ∞ τ s o τ s = η/GRAMO ∞
donde G ∞ es el módulo de cizallamiento instantáneo ("frecuencia infinita") o no relajado medido en una escala de tiempo tan corta que un líquido no tiene tiempo suficiente para fluir en respuesta a un esfuerzo aplicado. G ∞ cambia con la temperatura más rápidamente para líquidos frágiles. El tiempo de relajación es el tiempo promedio que le toma a un fluido viscoso eliminar toda la tensión asociada con un estrés de fluido impuesto. Un líquido es "similar a un sólido" en escalas de tiempo mucho más cortas que τ . Una definición común (pero no oficial) de T g es una viscosidad de 10 12 Pascal-segundos (equivalente a 10 13Poise) o un tiempo de relajación de 100 segundos (una definición que ha sido ampliamente desplazada por la determinación calorimétrica).
La ecuación VFT a veces se escribe directamente en términos de tiempo de relajación como:
τ s = τ o exp [DT o /(TT o )]
con τ o asignado un valor de 10 −14 segundos, lo que puede dar un buen ajuste para líquidos de fragilidad intermedia. Debido a que τ o y T o son constantes, la ecuación VFT a menudo se escribe utilizando las constantes A , B y C en lugar de τ o , DT o y T o , respectivamente.
En el modelo de Arrhenius, las energías de activación ( E a ) pueden aumentar por un factor de tres por debajo de T g [ ACTAS DE LA ACADEMIA NACIONAL DE CIENCIAS (EE.UU.); Bultink,J; 97(5):2385-2390 (2000) ]. Los cambios de energía de activación para la estabilidad de los liposomas en cristales de azúcar también se han informado en Tg [ BIOPHYSICAL JOURNAL; Sol,WQ; 70(4):1769-1776 (1996) ].
La temperatura de Kauzmann ( T K , "temperatura de transición vítrea ideal") es una temperatura hipotética a la que se supone que la entropía configuracional de un líquido sobreenfriado se reduce a la de un estado cristalino. El valor de T K se determina a partir de un gráfico de entropía configuracional ( S c ) frente a la temperatura de un vidrio que se está enfriando. [ La entropía configuracional también se llama entropía posicional , definida como el número de posiciones espaciales que las moléculas pueden ocupar en un sistema. La entropía configuracional se distingue de la entropía térmica JOURNAL OF CHEMICAL EDUCATION, Lambert,JL; 84(8):1548-1550 (2007)]. Extendiendo los valores de la curva de enfriamiento de entropía hasta el punto donde se cruza con la entropía del cristal se obtiene T K . Extender más la línea da lugar a la "Paradoja de Kauzmann", una "catástrofe de entropía" en la que el líquido sobreenfriado tendría una entropía más baja que el cristal [ JOURNAL OF THE INDIAN INSTITUTE OF SCIENCE; Rao,KJ; 81:3-13 (enero-febrero de 2001) ].
| Temperatura | Paradoja de Kauzmann |
|---|---|
![[ Temperatura Kauzmann ]](https://benbest.com/cryonics/Kauzmann.jpg) | ![[Paradoja de Kauzmann]](https://benbest.com/cryonics/Paradox.jpg) |
En los sistemas reales, el sobreenfriamiento no continúa indefinidamente y el resultado imposible asociado con la "catástrofe" T K se evita mediante la formación de vidrio. No obstante, la capacidad calorífica y otras variables a temperaturas por debajo de T g se acercan a las de un cristal, lo que indica que los cambios en la estructura molecular asociados con T g reducen el movimiento de traslación y rotación de las moléculas a "casi la inmovilidad" asociada con un cristal [JOURNAL OF PHARMACEUTICAL CIENCIAS; Zhou,D; 91(8):1863-1872 (2002)].
T K es una temperatura termodinámica hipotética para la cual se propone que la movilidad de las moléculas sea equivalente a la de un cristal (cerca de cero, pero no necesariamente). T o es una temperatura cinética hipotética que representa una viscosidad infinita (movilidad cero), determinada por el ajuste empírico de la ecuación VFT a temperaturas superiores a T g .
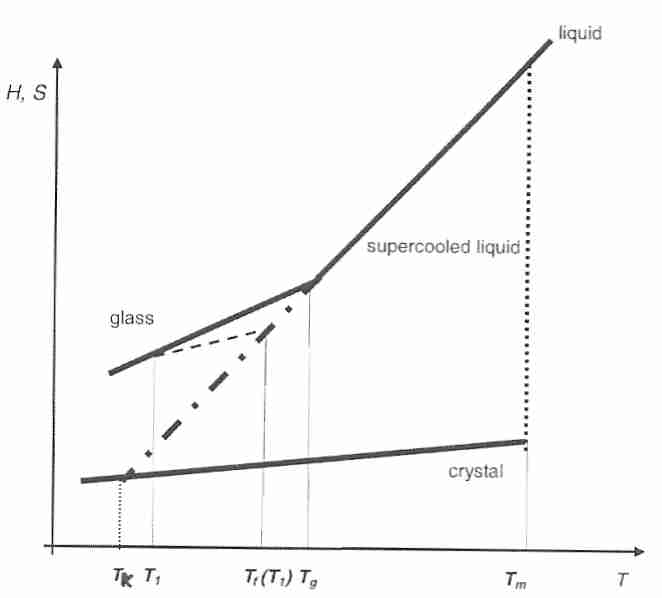 |
El enfriamiento a velocidades tan rápidas que no se puede medir la Tg durante el proceso de enfriamiento ("hiperapagado") es una herramienta útil para los investigadores que estudian los mecanismos de relajación y recocido porque los vidrios formados en estas condiciones tienen tiempos de relajación tan altos [JOURNAL OF NON - CRYSTALLINE SÓLIDOS; Wang,L; 353(41-43):3829-3837 (2007)]. La temperatura ficticia ( T f ) es la temperatura a la que un líquido sobreenfriado en equilibrio tiene la misma entropía (o entalpía) configuracional que el vidrio. Por encima de T g (es decir, en equilibrio líquido) T f = T . Tf depende en gran medida de la velocidad de enfriamiento. En hiperapagadoT f se determina después de que se haya formado el sólido. En estas condiciones, la Tg se determina al recalentar el vidrio y generalmente se define como un tiempo de relajación de 100 segundos o una viscosidad de 10 12 Pascal -segundos [ JOURNAL OF CHEMICAL FYSICS; Yue,Y; 120(17):8053-8059 (2004) ]. T f está limitada por T g y T K , es decir, TK < T f < T g [ REVISTA DE QUÍMICA FÍSICA; Shamblin,SL; 103:4113-4121 (1999)].
Por debajo de Tg , la relajación es tan lenta que el tiempo de relajación puede describirse como una función del tiempo, es decir, el tiempo de relajación cambia a medida que avanza la relajación. Tf es una función del tiempo que se aproximará a una temperatura T1 impuesta . T f se puede usar para escribir una ecuación VFT modificada (una forma de la ecuación de Adams-Gibbs ) para la cual la dependencia temporal de τ s está completamente determinada por cambios en T f :
τ s = τ o exp [DT o /(T(1 - (T o / T f ))]
[INVESTIGACIÓN FARMACÉUTICA; Mao,C; 23(8):1906-1917 (2006)].
 |
Para los formadores de vidrio fuertes T K puede ser tanto como el doble del valor de T o , pero para las sustancias frágiles T K está cerca del valor de T o . Para el etilenglicol, T K es un 5% mayor que el valor de T o [ CARTAS DE REVISIÓN FÍSICA; Tanaka,H; 90(5):055701; 1-4 (2003) ]. Para el glicerol , se encontró que T K era −138ºC y T o era −145ºC. Para el etilenglicol T K fue −158ºC y T o fue −164ºC [REVISTA DE INVESTIGACIÓN DEL INSTITUTO NACIONAL DE NORMAS Y TECNOLOGÍA; CA Angell; 102(2):171-185 (1997) ]. (Los valores son para soluciones puras en lugar de soluciones a concentraciones necesarias para vitrificar). Estos resultados no están lejos de la estimación de que para materiales amorfos frágiles, como los crioprotectores utilizados en criónica, la temperatura ( T o ) a la cual la movilidad molecular promedio se estima que "se aproxima a cero" a unos 50ºC por debajo de Tg [ THERMOCHIMICA ACTA; Hancock,BC; 380:95-107 (2001)]. La Tg de las soluciones de vitrificación utilizadas en criónica, en las concentraciones necesarias para vitrificar, está cerca de −124ºC. Cálculo de TKy la determinación empírica confirma que existe una movilidad molecular medible en los sólidos amorfos por debajo de T K [ BIOPHYSICAL JOURNAL; Walters,C; 86(2):1253-1258 (2004) ]. Se han determinado tiempos de relajación de 3 a 5 años a temperaturas cercanas a los 50ºC por debajo de T g para sorbitol amorfo, sacarosa, trehalosa e indometacina [JOURNAL OF PHYSICAL CHEMISTRY; Shamblin,SL; 103:4113-4121 (1999)]. La pérdida dialéctica en aisladores de vidrio cientos de grados por debajo de T g se ha atribuido a iones alcalinos móviles y protones [JOURNAL OF APPLIED Physics; Sección C; Ángell, CA; 88(6):3113-3156 (2000)].
Estas estimaciones significarían que se requeriría una temperatura de almacenamiento para pacientes criónicos en el rango de −165ºC a −175ºC para prevenir los efectos de la movilidad molecular, a saber, la desvitrificación y el daño molecular directo. Estas temperaturas están muy por debajo de las temperaturas de almacenamiento a temperatura intermedia ( ITS ) propuestas para evitar el agrietamiento.
A temperaturas superiores en un 20 % a la T g (a menudo denominada T c , temperatura crítica), la difusión traslacional y rotacional es inversamente proporcional a la viscosidad según las ecuaciones de Einstein-Stokes y Debye, respectivamente. Entre Tc y Tg , la ecuación de Debye para la difusión rotacional sigue siendo válida, pero la ecuación de Einstein-Stokes falla . Cerca de Tgel movimiento de traslación molecular en líquidos formadores de vidrio muy frágiles puede ser hasta dos órdenes de magnitud más rápido de lo que prediría Einstein-Stokes en función de la viscosidad [REVISTA DE FÍSICA QUÍMICA; Cicerone, MT; 104(18):7210-7218 (1996)]. El glicerol es lo suficientemente fuerte como para que la relación de Einstein-Stokes siga siendo válida para las temperaturas más bajas estudiadas [REVISTA DE FÍSICA APLICADA; Sección A.1.9.1; Ángell, CA; 88(6):3113-3156 (2000)], y esto probablemente también se aplica al etilenglicol, que tiene una fragilidad/resistencia similar.
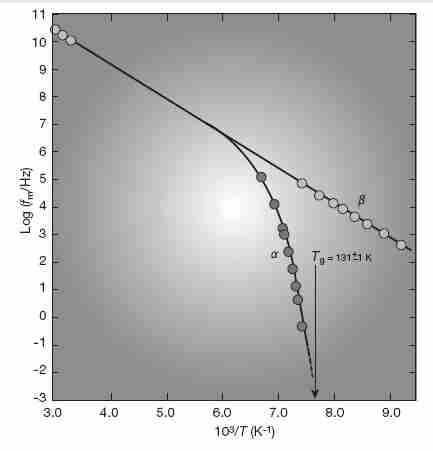 |
También en la región moderadamente por encima de Tg , el único mecanismo de relajación diverge cada vez más en un mecanismo de relajación lento ( α ) y rápido ( β ) a medida que se acerca a Tg desde arriba. El proceso de relajación lento ( α ) (que caracteriza a los líquidos frágiles) está asociado con la rotación molecular y la relajación del flujo en fluidos viscosos, y muestra un comportamiento no Arrhenius (más que exponencial). Por el contrario, el rápido ( β) el proceso de relajación (característico de los líquidos fuertes) está asociado con la excitación vibratoria (relajación de red de espín) y muestra el comportamiento de Arrhenius [REVISTA DE SÓLIDOS NO CRISTALINOS; Sokolov,AP; 172/174:138-153 (1994) y THEMOCHEMICA ACTA; Moynihan, CT; 280/281:153-162 (1996)]. El lento ( α ) proceso de relajación se desvanece por debajo de Tg .
Por debajo de la T g (alrededor de −124 ºC para las soluciones de vitrificación utilizadas en criónica), los tiempos de relajación deberían seguir una forma de Arrhenius, aunque todavía hay alguna desviación para los sistemas frágiles [REVISTA DE FÍSICA APLICADA; Sección B2; Ángell, CA; 88(6):3113-3156 (2000)]. A medida que la temperatura cae cada vez más por debajo de Tg , el comportamiento no Arrhenius disminuye rápidamente [ BIOPHYSICAL JOURNAL; Walters,C; 86(2):1253-1258 (2004) ]. La mayor parte del comportamiento no Arrhenius por debajo de T g se observa en sistemas moleculares heterogéneos donde las especies iónicas pequeñas retienen la movilidad molecular dentro de especies moleculares más grandes que se inmovilizan en T g [REVISTA DE SÓLIDOS NO CRISTALINOS; Mizuno,F; 352 (42/49): 5147-5155 (2006)]. Los sistemas frágiles son más heterogéneos que los sistemas fuertes. El comportamiento no Arrhenius se debe a cambios estructurales, y cuando los cambios estructurales se detienen en Tg , el comportamiento no Arrhenius desaparece por debajo de Tg . Pero aunque la estructura sea fija, el flujo puede ocurrir en un sólido vitrificado. El flujo ocurre incluso en un cristal por movimiento de defectos. Por razones similares, un vidrio que está muy por debajo de T g mostrará una viscosidad (movilidad molecular) que es una función de temperatura de Arrhenius, posiblemente hasta cero Kelvin.
| Viscosidades a T g | Pendientes en T g | Pendientes por debajo de T g |
|---|---|---|
![[ Viscosidades en T<sub>g</sub> ]](https://benbest.com/cryonics/Fragile_Viscosity.jpg) | ![[ Pendientes en T<sub>g</sub>]](https://benbest.com/cryonics/TgSlope.jpg) | ![[ Taludes por debajo de T<sub>g</sub> ]](https://benbest.com/cryonics/TwoSlopes.jpg) |
En la medida en que el componente no Arrhenius de la relación temperatura/viscosidad desaparece rápidamente por debajo de Tg , parece razonable extrapolar una línea de Arrhenius (fuerte) por debajo de Tg para estimar la viscosidad de los sólidos vitrificados (vidrios) a temperaturas inferiores a Tg . Pero el primer gráfico que se muestra en esta sección (etiquetado como "Formadores de vidrio fuertes y frágiles por encima de T g ") muestra todos los líquidos formadores de vidrio que tienen una viscosidad de 10 12 Pascal-segundos a T g . (En la década de 1980, cuando se hizo el primer gráfico, T g se definía típicamente como la temperatura donde la viscosidad es igual a 1012 Pascal-segundos.) Como muestra el gráfico en el primer cuadro anterior, cuando T g se determina colorimétricamente, la viscosidad a T g puede oscilar entre aproximadamente 10 8 Pascal-segundos (para los líquidos más frágiles) y 10 12 Pascal-segundos (para líquidos más frágiles). los líquidos más fuertes). Como se muestra en el gráfico del segundo cuadro, las pendientes para líquidos frágiles cerca de T g están en el rango de alrededor de 50 en una gráfica de T g /T contra log 10 η . Como se muestra en el gráfico del tercer cuadro, la pendiente de la línea es discontinua y cae de aproximadamente 50 a aproximadamente 10 con la transición al estado sólido a continuación.T g . La viscosidad en estado sólido es diferente de la viscosidad en estado líquido, y se le ha llamado "viscosidad de fluencia" para indicar flujo por movimiento de defectos (que también puede ocurrir en un cristal).
El único crioprotector que se muestra en el primer gráfico de esta sección es el glicerol, que tiene una fragilidad muy cercana a la del ZnCl 2 . El glicerol no se muestra en el gráfico del primer cuadro anterior, pero se muestra que el ZnCl 2 tiene una viscosidad a T g de 10 12 Pascal-segundos, que puede tomarse como un representante de la viscosidad a T g para los crioprotectores utilizados en criónica. Una línea que interseca log 10 η de T g /T = 1,0 en 12 con una pendiente de 10 tendrá una intersección y de 2. Entonces, la línea de Arrhenius para estimar valores de viscosidad logarítmica por encima de 1,1 T g /T(es decir, más del 10% por debajo de T g ) sería la ecuación lineal simple:
log 10 η = 10 (T g /T) + 2 donde η es la viscosidad en Pascal-segundos.
He usado esta fórmula para obtener estimaciones de los valores de η a varias temperaturas usando −123ºC (150 K) como el valor de T g (la T g aproximada de las mezclas de vitrificación utilizadas en criónica). La temperatura de almacenamiento intermedio (ITS) es de especial interés en criónica debido a la creencia de que almacenar pacientes a esta temperatura produciría muchas menos grietas debido al estrés térmico, y esta temperatura sería adecuada para la crioconservación durante décadas, si no siglos.
Para Temperatura de Almacenamiento Intermedio −135ºC (alrededor de 138 K) T g /T = (150/138) = 1.087 y la fórmula da:
log 10 η = (10*1.087) + 2 = 12.9 o η = 10 12.9 Pascal-segundos
Para los valores aproximados de T K o T o temperatura −165ºC (unos 108 K) T g /T = (150/108) = 1,39 y la fórmula da:
log 10 η = (10*1,39) + 1 = 15,9 o η = 10 15,9 Pascal-segundo
Para la temperatura del líquido −196ºC (alrededor de 77 K) T g /T = (150/77) = 1,95 y la fórmula da:
log 10 η = (10*1,95) + 1 = 21,5 o η = 10 21,5 Pascal-segundo
Por lo tanto, a la temperatura de almacenamiento intermedia (−135 ºC), el etilenglicol es aproximadamente 10 15 (un cuatrillón) de veces más viscoso que a 25 ºC (0,0161 Pa·s) y a la temperatura del nitrógeno líquido es casi 10 24 (un septillón) veces más viscoso. . (El jarabe de maíz es unas 85 veces más viscoso que el etilenglicol a 25ºC, y el etilenglicol es unas 18 veces más viscoso que el agua a esa temperatura).
En realidad, hay dos ecuaciones en la teoría cinética que se denominan relaciones de Einstein , la mencionada ecuación de Einstein-Stokes ( relación de Stokes-Einstein ):
k segundo T re
= ------
6πrη
y la relación de Einstein-Smoluchowski :
re = μ pags k segundo T
que utiliza la movilidad μ p como velocidad de deriva resultante de una fuerza aplicada μ p = V d /F . Eliminando D y resolviendo para μ p da la ecuación más simple:
1
μ p = ------
6πrη
La movilidad de deriva μ p estará en unidades de metros por segundo por Newton de fuerza aplicada. (Tenga en cuenta que Pa·s = kg/(m·s) y N = (kg·m)/s 2 ) Pero la única fuerza experimentada por un paciente de criónica sería la fuerza de la gravedad, opuesta por una fuerza igual y opuesta debajo el paciente, razón por la cual el paciente de criónica no se mueve. En el nivel molecular, las fuerzas serían aleatorias, lo que daría como resultado un movimiento browniano .
El uso de la ecuación de Einstein-Stokes para encontrar el coeficiente de difusión ( D ) para una temperatura ( T ) y una viscosidad ( η ) determinadas proporciona los medios para determinar el desplazamiento típico de una molécula de agua (radio = 1,4 x 10 −10 metros) después de un siglo del movimiento browniano en un paciente de criónica. El valor de k B ( constante de Boltzmann ) es 1,38 x 10 23 Joules/Kelvin, donde J/K = (kg·m 2 )/(s 2 K). Por lo tanto, la ecuación de Einstein-Stokes produce:
(1,38 kg·m 2 /s 2 K)(138K)
D a −135ºC (~138K) = --------------------------- ----------------------- = 9,09 x 10 −26 m 2 /s
6(3,1416)(1,4 x 10 −10 m)(10 12,9 kg/ (milisegundo))
De manera similar, D a −165ºC (~108K) = 7,11 x 10 −26 m 2 /s y D a −196ºC (~77K) = 1,27 x 10 −34 m 2 /s
La distancia típica que una molécula de agua se desplazará desde su posición inicial después de un tiempo t se puede estimar calculando la varianza ( σ 2 ) de la función de Green de la ecuación de difusión en tres dimensiones ( relacionando el movimiento browniano con un paseo aleatorio ):
σ 2 = 6 Dt
Usando un valor de t igual a un siglo (3.156 x 10 9 segundos basado en 365.2425 días por año) de almacenamiento para un paciente de criónica, y sacando la raíz cuadrada de la varianza da la distancia típica ( desviación estándar ) que tendrá una molécula de agua viajado desde su punto de origen por la constante de difusión ( D ) para una temperatura y viscosidad dadas.
Para temperatura de almacenamiento intermedia (−135 ºC, ~138 K), la distancia típica que se habrá desplazado una molécula de agua en el transcurso de un siglo es de unos 40 nanómetros, mientras que para −165 ºC (~108 K) el desplazamiento es de aproximadamente un nanómetro y en nitrógeno líquido temperatura (−196ºC, ~77K) la distancia es de aproximadamente un picómetro y medio. Todos estos valores parecerían aceptables en un paciente de criónica si la distancia lineal típica recorrida por la molécula de agua fuera la misma que la distancia total. Pero la distancia lineal total real (longitud de la trayectoria) recorrida por la molécula de agua debido al movimiento browniano será mucho mayor que el desplazamiento típico desde el punto de origen. Haciendo el mismo cálculo para una molécula de agua a temperatura ambiente (25ºC, unos 298K) utilizando la viscosidad del etilenglicol (0. 0161 Pa·s) da una distancia típica de unos 1,4 metros. Una molécula de agua a temperatura ambiente recorrería un trayecto mucho mayor que 1,4 metros en el transcurso de un siglo.
También es preocupante la posibilidad de que dentro del vidrio haya iones que sean mucho más móviles que las moléculas que constituyen el vidrio. Una especie iónica (probablemente protones) en el vidrio de fosfato de dihidrógeno de trimetilamonio es nueve órdenes de magnitud más móvil que las moléculas de vidrio, y los iones de sodio en el vidrio de disilicato de sodio son doce órdenes de magnitud más móviles que las moléculas de vidrio [DIARIO DE SÓLIDOS NO CRISTALINOS; Mizurno,F; 352 (42/49): 5147-5155 (2006)]. Las moléculas de agua pueden ser bastante móviles cuando están en vidrio de polidextrosa, y el dióxido de carbono es móvil en alcohol polivinílico (misma referencia).
Sin embargo, la movilidad molecular no es letal para las ranas de madera del norte que pueden pasar semanas o meses en un estado semicongelado [ THE FASEB JOURNAL; Costanzo,JP; 9(5):351-358 (1995) ]. Los efectos más dañinos de la movilidad molecular a temperaturas por debajo de T g deben ser las moléculas de agua que forman cristales o los radicales libres móviles. Con respecto a este último, el criobiólogo Peter Mazur fue citado al comienzo de este artículo diciendo: "... no hay ningún caso confirmado de muerte celular atribuido al almacenamiento a −196ºC durante unos 2-15 años y ninguno incluso cuando las células están expuestas a niveles de radiación ionizante unas 100 veces superiores durante hasta 5 años". [REVISTA AMERICANA DE FISIOLOGÍA; Mazur,P; 247 (3 Pt 1): C125-C142 (1984)].
Más experimentos que expongan los tejidos a la radiación ionizante podrían ser útiles para evaluar la seguridad para los pacientes de criónica de varias temperaturas inferiores a T g por encima de la temperatura del nitrógeno líquido. También se deben realizar experimentos para determinar la posibilidad de formación de hielo a temperaturas criogénicas durante períodos prolongados. Se necesita más información antes de poder afirmar con certeza que el daño debido a la movilidad molecular a la temperatura de almacenamiento intermedia no sería peor que los efectos del daño por agrietamiento.
[ NOTA : Se estimaron aumentos más pronunciados de la viscosidad con la disminución de la temperatura para 7,05 M DMSO ( T g = −132 ºC) con viscosidad η = 10 18 Pascal-segundos) para −140 ºC CRIOBIOLOGÍA; Rabin,Y; Figura 11; 53(1):75-95 (2006) , pero REVISTA DE FÍSICA APLICADA; Sección A.1.2.1; Ángell, CA; 88(6):3113-3156 (2000) y otras citas anteriores dejan claro que esta cifra es exagerada porque se basa en una aplicación inapropiada de la ecuación VFT por debajo de Tg ] .
 diciembre 16, 2022
diciembre 16, 2022

